
在我们国内,大量的关于PED的流行性疾病调查发现,当前的流行毒株为GII基因型,其中GIIa基因型的检出率远高于GIIb基因型,尽管有些猪场内能同时检测到GIIa和GIIb基因型的野毒,但可以确定的是目前的流行毒株为GIIa基因型。
2010年以来PEDV GII基因型变异毒株爆发成为流行毒株的一个重要原因是当时GI基因型PEDV疫苗不能提供很好的交叉保护。但对于GIIa和GIIb基因亚型之间的交叉保护效力如何,截止目前的可参考研究资料较少。本篇译文的研究发现:GIIa基因型的灭活疫苗能够保护所有仔猪(8/8)免受同源(GIIa)和异源病毒(GIIb)的攻击,而GIIb基因型的灭活疫苗仅保护2/4和1/4仔猪免受同源(GIIb)和异源(GIIa)病毒的攻击。其中机理尚未阐明。
据了解在当前所有上市的PEDV疫苗中,仅有天康PEDV灭活疫苗“天福清“是唯一疫苗毒株为GIIa基因型的PEDV疫苗,其他的变异株疫苗为GIIb基因型的PEDV疫苗。
在天康制药公众号发表的方案解读五-《天福清免疫怀孕母猪后产生更高的针对GIIb基因型PEDV流行毒株的中和抗体》证明了:
1.天福清免疫怀孕母猪后产生更高的针对GIIb基因型PEDV流行毒株的中和抗体。
2.天福清对GIIb基因型PEDV疫苗的异源强化免疫产生的针对GIIb基因型PEDV流行毒株的中和抗体水平高于GIIb基因型PEDV疫苗对自身的同源强化免疫产生的中和抗体水平。
译文题目
两种细胞源GIIa和GIIb基因型猪流行性腹泻病毒灭活疫苗在哺乳仔猪中的免疫原性和交叉保护效果的评价与比较
Evaluation and comparison of immunogenicity and cross-protective efficacy of two inactivated cell culture-derived GIIa- and GIIb-genotype porcine epidemic diarrhea virus vaccines in suckling piglets
全文链接:https://pubmed.ncbi.nlm.nih.gov/30827401/
摘要:尽管高毒力的GII基因型PEDV毒株已在全世界猪群中流行,但对于GIIa和GIIb基因亚型之间的免疫原性和交叉保护效力的差异知之甚少。因此,在本研究中,我们GIIa(CH/HBXT/2018)和GIIb(CH/HNPJ/2017)PEDV灭活疫苗接种哺乳仔猪,并比较其免疫原性和交叉保护效力。结果表明,两种候选疫苗均诱导乳猪产生高水平PEDV特异性IgG抗体IFN-γ中和抗体。GIIa的灭活疫苗保护所有仔猪(8/8)免受同源和异源强毒攻击,而GIIb灭活疫苗分别仅保护2/4和1/4仔猪免受同源和异源强毒攻击。此外,GIIa和GIIb毒株的抗体在体外这两种毒株。综上所述,本研究中提供的数据表明,与GIIb候选灭活疫苗相比,GIIa的候选灭活疫苗在开发针对当前高毒力大范围流行性PEDV毒株的有效疫苗方面更有。
关键词:猪流行性腹泻病毒,免疫原性,保护效果,灭活疫苗,哺乳仔猪
1引言
猪流行性腹泻(PED)是由猪流行性腹泻病毒(PEDV)引起的一种高度传染性疾病,可导致哺乳仔猪的高死亡率(高达100%)。PEDV于1971年在英国首次发现,后来在许多欧洲国家发现。2010年10月,在中国发生了一次广泛的PED暴发,该暴发由与经典毒株CV777不同的高毒力PEDV变种引起。随后,从2013年4月开始,美国报告了高毒力和S-INDEL PEDV毒株。迄今为止,许多北美、亚洲和欧洲国家都报告了PEDV。
系统进化树研究表明,PEDV在遗传上可分为两种基因型:GI型(经典型)和GII型(田间流行型)。每个基因型可进一步分为亚基因型GIa和GIb以及GIIa和GIIb。目前,全世界最流行的PEDV株,特别是在中国,是GII型而不是GI型。以往的研究中已经报道了GI和GII之间以及GIa和GIb之间在致病性和交叉保护方面的差异,但还没有关于GIIa和GIIb之间差异的信息。因此,在本研究中,我们分别基于新分离的GIIa和GIIb PEDV毒株,CH/HBXT/2018和CH/HNPJ/2017,开发了两种细胞培养衍生的PEDV候选灭活疫苗,并评估和比较了它们对哺乳仔猪中同源和异源PEDV毒攻的免疫原性和保护效力。
2方法和技术
2.1.细胞和病毒
非洲绿猴肾(Vero)细胞(ATCC CCL-81)在DMEM培养基中生长,该培养基含有10%灭活胎牛血清(FBS;Invitrogen,澳大利亚)和1%抗生素(10000单位/mL青霉素、10000μg/mL链霉素和25μg/mL两性霉素),并在37℃和5%CO2下培养。
如我们先前的研究所述,在我们实验室分离的一株中国GIIa PEDV毒株CH/HBXT/2018(GenBank登录号:MH816969)在Vero细胞中繁殖。简而言之,将全部培养从T-75培养瓶中的单层Vero细胞中,并用无菌PBS洗细胞三次。然后,将3ml制备的病毒原液接种到装有20μg/mL胰蛋白酶的培养瓶中。在37°C和5%CO2条件下孵育1小时后,再添加5ml病毒生长培养,并在37°C和5%CO2下继续细胞培养,每天观察细胞病变效应(CPE)。当90%以上的细胞出现CPE时,收集上清液和细胞,冷冻和解冻三次,并在-80°C下储存,以备下次病毒传代。同样,在我们的实验室中,还分离并在Vero细胞上了一株中国GIIb PEDV毒株CH/HNPJ/2017(GenBank登录号:MF152604)。
2.2.疫苗的制备
根据先前研究中描述的方法,使用二元亚乙基亚胺(BEI)对细胞的GIIa PEDV毒株CH/HBXT/2018(105 TCID50/mL)和GIIb PEDV毒株CH/HNPJ/2017(105·2 TCID50/mL)的第二十代(P20)进行化学灭活。简而言之,是从T-75瓶中培养的Vero细胞中获得的。在三次冻融循环后,通过离心收集病毒上清液,然后通过添加0.2M BEI至2mM的最终浓度使其失活,并在30°C下培养24小时。培养后,通过添加20%硫代硫酸钠将剩余的BEI中和。通过Vero细胞培养物和仔猪接种后没有病毒生长,验证了灭活的成功。根据使用说明,将BEI灭活GIIa PEDV CH/HBXT/2018-P20和GIIb PEDV CH/HNPJ/2017-P20与弗氏完全佐剂混合,制备灭活疫苗,并将疫苗储存在4℃直至接种。
2.3.猪只免疫与攻毒试验
从一个商品猪场获得了24头未感染PEDV的新生仔猪(3-5日龄),该养猪场之前没有PED爆发或PEDV疫苗接种的群体历史。在接种疫苗之前,分别用商品化ELISA试剂盒和实时PCR检测所有仔猪的血清IgG抗体水平和粪便中的病毒排毒情况。所有小猪都是在兰州兽医研究所的实验动物设施中饲养。在实验期间,所有仔猪每天只喂养商品化的多次。动物使用协议由兰州兽医研究所机构动物使用和护理委员会审查和批准。本研究中使用的所有仔猪在实验期间都得到了很好的照顾,并在出现明显的临床症状和直肠拭子样本中发现的PEDV RNA粪便排毒时被安乐死。
将24头仔猪随机分为三组:GIIa基因型的 PEDV CH/HBXT/2018-P20灭活疫苗组(n=8)、GIIb基因型的 PEDV CH/HNPJ/2017-P20灭活疫苗组(n=8)和模拟对照对照组(n=8)。接种疫苗后,这些仔猪被安置在单独的房间里。两个灭活疫苗组中的仔猪在接种后0天(dpv)用2ml适当制备的灭活疫苗进行一次肌肉注射免疫。模拟对照对照组的仔猪仅注射生理盐水PBS。在免疫后21天dpv下采集血清样本进行抗体检测。在免疫后21天 dpv时,将三组中的每头仔猪随机分为两个平行的亚组,并口服3 mL中值猪腹泻剂量(PDD50)1000倍的细胞培养传代适应的GIIa 强毒株CH/HBXT/2018-P4(起始PDD50:8.63 log10PDD50/mL)或GIIb强株CH/HNPJ/2017-P4(起始原始PDD50:7.68 log10PDD50/3mL)的中值猪腹泻剂量(PDD50)的1000倍。攻毒后,每天观察仔猪的PEDV感染临床症状,连续观察7天,并根据先前研究中的描述确定粪便稠度的临床分数,如下所示:0=正常;1=糊状;2=半液体;3=液体。攻毒后,每天使用直肠拭子收集粪便样本,并在激发期间立即进行测试,以监测粪便中的排毒情况。
2.4.RT-PCR
根据生产商的说明,使用RNeasy微量试剂盒从肠道内容物中提取病毒RNA。如前所述进行PED N基因的实时PCR。
2.5.ELISA和病毒中和(VN)试验
根据生产商的说明,使用商用间接ELISA(I-ELISA)试剂盒评估通过GIIa CH/HBXT/2018-P20和GIIb CH/HNPJ/2017-P20疫苗免疫引起的PEDV特异性IgG抗体反应。
如前所述,通过细胞的GIIa PEDV CH/HBXT/2018毒株的试验(HBXT VN)和细胞GIIb PEDV CH/HNPJ/2017毒株的试验(HNPJ VN)测定从所有组仔猪采集的血清样品中的中和抗体。简言之,在37℃下将以1:2开始的倍稀释与96孔板中含有200 TCID50病毒的等体积病毒原液共1小时。然后,将混合物接种到Vero细胞单层96孔板中,用PBS洗三次,并在37℃下孵育1小时。孵育后,丢弃混合物,并用PBS冲洗该板三次。接下来,向每个孔中加入含有胰蛋白酶(20μg/mL)的维持培养基,并在37℃下培养5天。中和抗体滴度计算方法为完全抑制的最高血清稀释度的倒数。
2.6.细胞因子检测(IFN-γ)
所有组仔猪血清样品中的IFN-γ水平均在21采集,并根据制造商的说明用市售猪IFN-β ELISA试剂盒测定。
2.7.统计分析
使用SPSS16软件进行统计分析。使用单因素方差分析和Tukey多重比较检验确定不同实验组之间的统计显著性。当P值小于0.05时,差异被认为是显著的。
3结果
3.1.临床观察和粪便排毒检测
实验前后,对所有仔猪进行了密切监测。对所有仔猪血清中PEDV特异性IgG抗体和粪便排毒的检测结果表明,三组仔猪PEDV阴性,粪便中没有排毒。此外,所有仔猪都明显健康,在攻毒前没有临床症状。
攻毒后,各组的粪便排毒通常伴有临床症状(表1)。具体而言,在验期间,1000 PDD50细胞的GIIa CH/HBXT/2018-P4和GIIb CH/HNPJ/2017-P4攻毒后,GIIa CH/HBXT/2018灭活疫苗组(n=8)的仔猪未显示任何PED的临床症状排毒。在用GIIa毒株的GIIb CH/HNPJ/2017灭活疫苗组的仔猪(n=4)中,三头仔猪在后2至5天(DPI)出现水样腹泻(临床评分:3)和粪便中排毒(循环阈值(CT)值:24.27–25.44);在确认PEDV感染后,对这些仔猪实施安乐死(表1)。此外,在GIIb毒株的GIIb CH/HNPJ/2017灭活疫苗组的仔猪(n=4)中,两头PEDV阳性仔猪(临床评分:2-3,CT值:24.32-26.23)(表1)。在组中,接种GIIa毒株的所有仔猪(n=4)在2到3之间检测到PEDV阳性(临床评分:2-3,CT值:17.72-23.02),而接种GIIb毒株的所有小猪(n=4)在4 检测到PEDV阳性(临床分数:2-4,CT值23.02-28.20)。
表1各组仔猪的临床评分和粪便排毒汇总
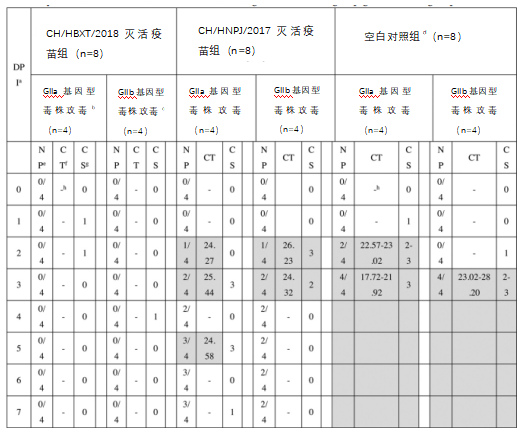
a-仔猪接种后天数。
b-给仔猪口服3毫升含猪腹泻中位剂量(PDD50)1000倍的细胞传代病毒CH/HBXT/2018-P4(原始PDD50:8.63log10PDD50/3毫升)
c-给仔猪口服3毫升含猪腹泻中位剂量(PDD50)1000倍的细胞传代病毒CH/HNPJ/2017-P4(原始PDD50:7.68 log10PDD50/3毫升)。
d-组的仔猪口服接种3毫升PBS。
e-PEDV阳性仔猪的数量。
f-周期阈值;大于30的值被视为阴性或低于实时PCR的检测限。
g-粪便稠度的临床评分如下:0=正常;1=糊状;2=半液体;3=液体。
h-无Ct值(未检测到PEDV RNA)的样品用(-)表示。
灰色方块表明,用临床症状和粪便排毒证实感染后,PEDV阳性仔猪被安乐死。
3.2.免疫猪血清中的PEDV IgG抗体水平和中和抗体水平
通过I-ELISA和试验评估两种实验疫苗诱导的血清抗体反应。如图1a所示,从两个灭活疫苗组收集的21的血清样品I-ELISA试剂盒测定PEDV特异性IgG抗体阳性,而来自组的所有样品均为阴性。与组相比,两个灭活疫苗组的PEDV特异性IgG抗体水平显著升高(p0.05)。
如图1b和c所示,GIIa CH/HBXT/2018毒株灭活疫苗或GIIb CH/HNPJ/2017毒株的灭活疫苗的仔猪血清在21测到抗体。GIIa基因型的 CH/HBXT/2018毒株的PEDV灭活疫苗诱导的阳性血清样品针对HBXT VN和HNPJ VN毒株具有相似的中和抗体滴度,两者之间没有显著差异(p>0.05)(图1b和c)。然而,针对HBXT 和HNPJ 毒株,GIIb基因型的 CH/HNPJ/2017毒株的PEDV灭活疫苗诱导的阳性血清样品具有不同的中和抗体水平,而且,两者之间存在显著差异(p<0.05)(图1b和c)。阳性HNPJ血清样品用同源病毒HNPJ病毒检测的的中和抗体水平高于用异源病毒HBXT毒株检测的中和抗体水平(图1b和c)。从组收集的免疫后21天的血清样品(阴性血清)在对HBXT毒株和HNPJ毒株的中和抗体测定中均为阴性。
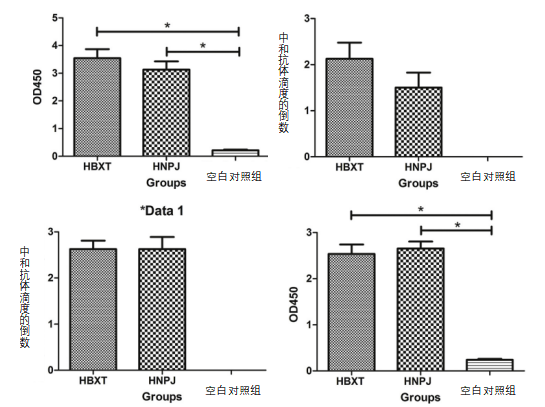
图1.用基于GIIa(CH/HBXT/2018)和GII2b(CH/HNPJ/2017)PEDV毒株的候选灭活疫苗免疫仔猪产生的体液和细胞免疫应答水平。猪在接种后0天接种(dpv),然后用同源强毒(GIIa免疫仔猪用GIIa株CH/HBXT/2018)和异源强毒(GIIa免疫仔猪用GII2b株CH/HNPJ/2017)攻毒。a:仔猪在免疫后21天的IgG水平。星号表示显著差异(P<0.05)。b和c:针对GIIa(CH/HBXT/2018)和GII2b(CH/HNPJ/2017)PEDV毒株的中和抗体滴度。d:免疫后21天的仔猪的细胞因子IFN-γ的水平。
3.3.免疫猪的IFN-γ水平
如图1d所示,在用基于GIIa CH/HBXT/2018毒株的灭活疫苗或基于GIIb CH/HNPJ/2017毒株的灭活疫苗免疫的仔猪血清中检测到IFN-γ,而在组的血清中未检测到IFN-γ。两个灭活疫苗组的IFN-γ水平显著高于组(p0.05)(图1d)。
3.4.仔猪攻毒后的保护效果
两种灭活疫苗对同源和异源强毒(1000 PDD50/3 mL GIIa PEDV毒株CH/HBXT/2018-P4)攻毒的保护效力由7天观察期内无临床症状和排毒减少确定。结果表明,基于GIIa CH/HBXT/2018毒株的灭活疫苗可以保护所有仔猪(8/8)免受同源和异源强毒的毒力攻击(表1),而基于GIIb CH/HNPJ/2017毒株的灭活疫苗仅保护2/4和1/4仔猪免受同源和异源强毒的毒力攻击。组的仔猪在毒力同源或异源强毒攻击后没有受到保护(表1)。
4讨论
经典PEDV毒株为基础的减毒/灭活疫苗的失败以及强毒力GII基因型PEDV(田间流行)毒株引起的PED的严重性使得开发有效疫苗势在必行。许多流行病学研究表明,强毒力GII-PEDV毒株已在全世界猪群中流行。此外,根据先前的研究,经典和新兴PEDV毒株之间的抗原变异可能导致亚洲传统减毒疫苗的免疫失败。因此,我们的实验室先前在Vero细胞中分离并连续传代了两株强毒力的GII-PEDV株CH/HBXT/2018(GIIa)(未公开)和CH/HNPJ/2017(GIIb),用于下一代疫苗开发。此外,还进行了GI和GII之间以及GIa和GIb之间的交叉保护实验,显示了不同基因型毒株之间交叉保护效果的差异。然而,到目前为止,还没有关于GIIa和GIIb之间交叉保护效果的信息。因此,在本研究中,评估了两种细胞传代的GIIa和GIIb-PEDV毒株灭活疫苗在哺乳仔猪中的免疫原性和交叉保护效力;此外,还评估了两种灭活疫苗之间的交叉中和作用。
迄今为止,大多数PEDV攻毒研究都选择TCID50作为PEDV攻毒毒株的感染滴度。然而,我们先前的研究表明,猪体内PEDV毒株的感染滴度高于体外的Vero细胞。因此,为了评估疫苗在体内的效力,有必要用标准化和有效剂量的PEDV攻毒仔猪。因此,在本研究中,我们使用猪腹泻剂量中位值(PDD50)作为攻毒的标准感染性滴度,以评估疫苗效力。
在PEDV灭活疫苗的许多效力试验中,通常使用多剂量疫苗接种计划,包括2或3周间隔的2或3次疫苗肌肉注射,以获得血清和初乳中高水平的中和抗体。此外,怀孕母猪是评估PEDV灭活疫苗在目标群体(如新生仔猪)中效果的最佳动物模型,因为通过初乳将母体抗体转移到仔猪身上可能在哺乳仔猪PEDV保护性免疫中发挥重要作用。然而,在本研究中,为了克服饲养房间和饲喂的限制,并且符合中国兽医生物制品的相关评估标准,我们使用新生仔猪(3-5日龄)评估了我们的试验性候选灭活疫苗的保护效力,所有仔猪在攻毒前只接受了一次疫苗接种。因此,本研究中确定的中和抗体水平低于许多先前相关研究中报告的水平。在我们未来的研究中,我们将进一步评估这两种候选灭活疫苗在猪的不同生长阶段的免疫原性和保护效力。
5结论
本研究中的数据表明,基于GIIa(CH/HBXT/2018)和GIIb(CH/HNPJ/2017)PEDV毒株的候选灭活疫苗均能诱导哺乳仔猪产生高水平的PEDV特异性IgG抗体,并提高免疫后21天的中和抗体水平。此外,两种候选灭活疫苗均比组诱导更高水平的IFN-γ。基于GIIa的灭活疫苗保护所有仔猪(8/8)免受同源和异源强毒攻击,而基于GIIb毒株的灭活疫苗分别仅保护2/4和1/4仔猪免受同源和异源强毒攻击。而且,抗GIIa和GIIb毒株的抗体在体外交叉反应并交叉中和了这两种毒株。
刘武刚

执业兽医师
华中农业大学预防兽医学硕士
在天津宝迪、正邦等集团从事猪群健康管理、生产技术管理和兽医团队管理工作近十年,对猪场生物安全体系搭建及猪呼吸道相关疾病和腹泻疾病积累了丰富的经验。现任天康生物制药有限公司技术服务经理,乳源免疫力推广大使。