

免疫的母猪可经多种途径将猪圆环病毒2型传播至仔猪
文章出处
本文翻译自Cheryl M.T. Dvorak主稿的《Multiple routes of porcine circovirus type 2 transmission to piglets in the presence of maternal immunity》一文。
文章导读
PCV2属于经济损耗性疾病,在家猪和野猪中普遍存在。近20年,PCV2疫苗的广泛使用为解决圆环病毒相关疾病的危害发挥了重要作用。仔猪接种疫苗,可以明显改善料肉比、生长速度及死亡率等生产指标。与此同时,母猪接种疫苗,可以改善母猪的生产性能,但并不能完全阻止仔猪早期感染。仔猪依然受到母猪及环境中PCV2感染的威胁,很多仔猪在接种前已经感染PCV2。
猪圆环病毒2型(PCV2)可引起猪圆环病毒相关疾病(PCVAD),疫苗可控制疾病,但不能清除感染,该病在全美猪场广泛流行。我们检测了母猪、哺乳前仔猪的PCV2病毒学和免疫学状态以及母猪场的分娩环境,以确定分娩时PCV2暴露风险、传播动力学和免疫学影响。PCV2在6个美国中西部母猪场的分娩环境和猪群中呈广泛分布,与母猪接种状态无关。在母猪血清和初乳中观测到高水平的PCV2衣壳特异性抗体,对PCV2传播和仔猪感染无明显影响。在来自59头母猪的281头哺乳前仔猪中,在63%的血清样本和93%的腋窝皮肤拭子中检测到PCV2 DNA。59头母猪中的58头的一个或多个样本和分娩环境中存在PCV2。通过测序显示,所有农场从母猪、哺乳前仔猪和环境中分离的感染性病毒样本在遗传上相似。总之,仔猪在母猪子宫内很容易感染PCV2,并且通过接触感染母猪和污染的分娩环境,持续受到PCV2的感染。然而,母猪免疫不影响PCV2向仔猪的传播或母猪的病毒载量。这些结果说明了尽管具有强效抗PCV2免疫,但母猪感染在新生仔猪早期感染中具有重要性,另外需要开发适当的感染模型来阐明保护性免疫机制。

一、引言
猪圆环病毒2型(PCV2)广泛存在于全美猪场,是PCV相关疾病(PCVAD)的病原体。通常在断奶前后对仔猪接种疫苗可有效预防PCVAD并降低血清中的PCV2水平,但不能清除感染。由于美国几乎所有育成猪群均接种了疫苗,对PCV2施加了大规模的免疫压力,因此在存在抗PCV2疫苗应答情况下,促使新毒株的出现。除预防PCVAD外,为了实现病毒消除,有必要更好地了解抗PCV2的免疫机制。
开发用于阐明抗PCV2免疫机制的相关研究模型,需要了解猪何时以及如何在自然农场环境中暴露于PCV2并散播感染性PCV2。育成猪的感染似乎发生在10-15周龄,此时猪群会出现病毒血症,几乎所有育成均感染PCV2,表明后备母猪和母猪也感染。与此可能性一致的是,可在育种母猪、新生仔猪和10周龄以下无疾病体征的仔猪中检出PCV2 DNA。PCV2的散毒途径包括初乳、乳汁、粪便、鼻拭子及口腔拭子。PCV2病毒在环境中比较稳定。所有这些信息表明,仔猪在生命早期(如果不是在妊娠期间)以及整个哺乳期间通过接触母猪和环境而暴露于PCV2。
免疫母猪通过初乳和乳汁向仔猪递送PCV2抗体。建议使用母源抗体来控制而不是预防新生仔猪的PCV2感染。对妊娠母猪接种疫苗可增加血清、初乳和乳汁中的抗体水平,包括中和抗体,但不能完全阻止仔猪感染。

在此,我们检测了美国中西部母猪场的母猪、哺乳前仔猪和产仔环境的PCV2病毒学和免疫学状态,以确定产仔时PCV2暴露风险、传播动力学和免疫学影响。对这种大小、深度和疫苗接种状态的研究是新颖的。观察到即使存在高水平抗体,PCV2在母猪养殖场中广泛分布,也存在于母猪血清和分泌物中,并且存在于哺乳前仔猪血清中。在细胞培养物中回收感染性PCV2,测序显示存在多个毒株。仔猪在子宫内感染非常普遍,出生后通过与母猪和产仔环境接触而不断受到PCV2感染的威胁。重要的是,尽管PCV2抗体水平持续升高,但PCV2在接种疫苗母猪群中的传播无差异。
二、材料与方法
1、农场采样
选取明尼苏达州、爱荷华州和印第安纳州的6个商业母猪养殖场,对每个养殖场同一天分娩的6-14头母猪进行采样,共采样59头母猪和281头仔猪(表1)。采样农场代表了典型的商业养猪模式,具有不同的健康状况,包括PRRSV阳性但未进行故意暴露的农场(表1,未显示健康状况)。根据惯例,所有农场母猪在仔猪断奶时接种PCV2疫苗。在6个农场的2个中,母猪分娩前3-4周用单剂量产品(Circumvent PCV, Intervet Inc.,或Ingelvac CircoFLEX, Boehringer Ingelheim Vetmedica, Inc)进行加强免疫(表1)。
每头母猪对应最多5头新生仔猪进行哺乳前采血,并放入凝血管中。抓取仔猪,移至洁净区,防止环境污染。分离血清,等分,冷藏(4℃)短期储存。于产仔后12 h内采集母猪初乳,分离水相部分。手动采集母猪粪便,并置于收集袋中。一旦观察到干净的胎盘样本,立即切除。所有样品均在-20℃下冷冻储存,用于后续分析。将无菌聚酯尖端涂抹器置于面颊与牙龈之间5-10s,采取所有母猪口腔拭子。采用深腔培养拭子采集子宫液,以尽量减少其他液体的污染。通过用干燥聚酯尖端涂抹器擦拭,采集母猪和仔猪腋窝皮肤表面以及妊娠板条箱底部和表面的样本。进行腋窝皮肤表面采样是因为其在分娩期间和分娩后最不可能直接暴露于环境之中,并且之前用于评估宫内病毒暴露(personal communication, Dale Polson,Boehringer Ingelheim Vetmedica, Inc., St. Joseph, MO)。将拭子置于500mL磷酸盐缓冲盐水(PBS)中,冷藏12-24h。然后离心获取液体,并在-20℃冷冻。消毒前后对未使用的产房进行采样,采用swiffer型衬垫沿混凝土过道、地板过道、板条箱地面、板条箱栏和板条箱侧壁擦拭。将每个衬垫与30mL PBS混合,至于塑料拉链袋中,并将液体在-20℃下冷冻。大约分娩后3天,采集母猪血液,并重复采集母猪粪便、皮肤和环境表面(板条箱和地板)样品。采集死胎和出生后3天内死亡的仔猪(每头母猪最多2只) 腋窝皮肤表面样品,并采集胸液、腹股沟淋巴结(ILN)、肠系膜淋巴结(MLN)、肝、肺、脾、肾、空肠、回肠、结肠、扁桃体和心脏组织样品。采集木乃伊胎腹部组织样本。所有组织样本均在-20℃下冷冻。
本研究按照明尼苏达大学机构动物护理和使用委员会(IACUC)批准的编号0909A72512动物伦理使用方案进行。

2、DNA分离和病毒拷贝数测定
根据生产商的方案,使用QIAamp DNA迷你试剂盒(Qiagen, Valencia, CA)从血清、初乳、胸液和拭子(口腔液、皮肤、子宫和环境)中分离DNA,使用Qiagen DNeasy试剂盒从冷冻组织中分离DNA,样本体积为200μL,并在50μL无菌水中进行最终洗脱。根据生产商的方案,使用QIAamp DNA试剂盒(Qiagen, Valencia, CA)从粪便中提取DNA,样本重量为200 μg,最终在200μL无菌水中洗脱。所有分离的DNA样品均在-20℃下储存。
如前所述(Dvorak et al., 2013),使用定量PCR试验测定PCV2的DNA拷贝数。试验前按1:10稀释粪便和组织DNA样品。使用已知数量的PCR产物来确定病毒拷贝数以及PCV2a和PCV2b的阳性和阴性对照,在每个平板上运行标准曲线。检测的灵敏度为500个病毒拷贝/ml样本或250个病毒拷贝/拭子。该试验对PCV2a和PCV2b的扩增均具有特异性,通过熔解曲线分析进行区分。
3、PCV2特异性抗体的ELISA分析
使用标准ELISA方法分析血清、初乳和口腔液样本中的PCV2衣壳特异性抗体(Puvanendiran et al., 2011)。反应板用200ng PCV2衣壳蛋白包被,并在碳酸盐缓冲液(pH 9.6)中过夜,然后用含0.02%吐温20(PBST)的PBS(pH 7.4)洗涤,并用含5%脱脂奶粉的PBST(pH 9.6)封闭2h。清洗平板,加入稀释后的样品(血清1:50,初乳1:5000用于测定IgG,初乳1:50用于测定IgM和IgA,口腔液体1:3用于所有Ig同种型),室温下孵育1h。清洗平板,如下所示加入抗体:辣根过氧化物酶标记的猪抗IgG-、IgM-或IgA- (HRP, Bethyl Laboratories, Inc, Montgomery, TX),血清按1:100,000稀释,初乳和口腔液按1:25,000稀释,室温下孵育1h。清洗平板,向各孔中加入四甲基联苯胺(TMB)过氧化物酶底物溶液(KPL, Inc., Gaithersburg, MD),放置15min显色。使用1M磷酸淬灭显色,并使用ThermoMax酶标仪(Molecular Devices, Sunnyvale, CA)在450nm处读取数值。基于2倍背景值,将吸光度读数> 0.1视为阳性,并使用阴性对照样本进行确认。

4、病毒分离
液体样品经0.22μm注射器式过滤器(Millipore Corporation,Bedford, MA)过滤,并在Suresh Tikoo博士(VIDO, Saskatchewan, Canada)惠赠的PCV1和PCV2阴性的VIDO R1BL细胞(VR1BL) (Reddy et al., 1999;Zakhartchouk et al., 2003)中培养,以检测感染性病毒。通过使用不含FBS的组织培养基的Centricon 3滤芯(Millipore Corporation, Bedford, MA)进行2次缓冲液交换,然后通过0.22μm注射器式过滤器(Millipore Corporation, Bedford, MA)过滤,去除产房表面样品中的细胞毒性因子。在48孔板中加入50μL样品,在37℃振荡条件下感染细胞1h。除去接种物,清洗细胞,加入完全培养基,在37 ℃、5%CO2条件下孵育细胞约3天,然后再盲传5次。若细胞仍存活,表明细胞毒性因子去除完全。每次传代时,将细胞胰蛋白酶化,取一半进行流式细胞仪分析,一半进行再培养。
如前所述(Dvorak et al., 2013),使用BD Cytofix/Cytoperm试剂盒(BD Biosciences, San Jose, CA)对VR1BL细胞进行固定和透化处理,然后进行流式细胞多色分析(FACS分析)。为验证流式细胞数据,用第6代上清液感染VR1BL细胞4天,然后用上述相同抗体进行染色。使用Olympus FV1000共聚焦显微镜观察阳性细胞,并用FluoView软件(Olympus,Melville, NY)记录数据。

5、病毒测序
使用AccuStart PCR SuperMix(Quanta BioSciences Inc,Gaithersburg,MD)、Cap F(5’CCGTTGGAATGGTACTCCTC3’)和Cap R(5’ACAGCGACAGCGCACTTCTTTCGTTT3’)引物对选定的阳性样本进行PCV2基因组区域扩增,包括部分ORF2(衣壳)基因序列。使用引物N1F(5’AGAACAATCCACGGAGGAAG3’)和N1R(5’GGAAAAAGGAAAAATGGCATCTTCAAC3’)进行第二轮PCR。扩增产物在琼脂糖凝胶上显色,切下阳性条带,并按照生产商的方案使用ExoSAP-IT(Affymetrix, Inc, Santa Clara, CA)进行清理,或使用QIAquick凝胶提取试剂盒(Qiagen, Valencia, CA)进行凝胶纯化和分离。在明尼苏达大学生物医学基因组学中心使用NIF和NIR引物对样本进行测序。采用Lasergene SeqMan软件(DNASTAR, Madison, WI)对轨迹文件进行SNP分析。使用含有586个碱基(包括碱基972-1557)的全序列样本(根据我们实验室PCV2b菌株JF290418序列中的碱基编号)进行比较分析。使用Geneious Pro v5.6.2软件(Drummond et al.,2011)创建样本序列以及原型病毒的树状图和每个分支的代表(Olvera et al.,2007;Segales et al.,2008)。使用MrBayes(Huelsenbeck and Ronquist,2001)组装系统发育树,链长为200,000,PCV-2c为外群。
6、统计分析
使用Prism 5 对 Mac OS X软件(GraphPad software, Inc., La Jolla, CA)进行统计检验。由于分布不是高斯分布,因此使用了非参数检验。采用Kruskal-Wallis检验进行ANOVA比较,采用Mann-Whitney检验进行t检验比较,采用Spearman进行相关性分析。
三、结果
1、母猪病毒和抗体水平
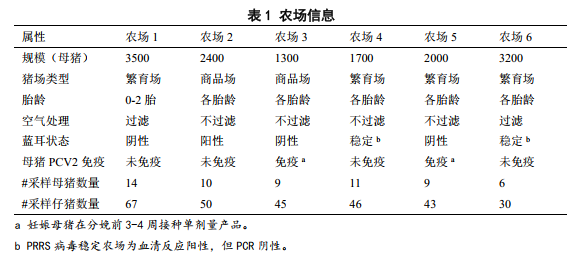
PCV2广泛分布于所有农场。母猪病毒血症的比例和水平因农场而异,农场1、3和4(分别为100%、89%和100%)的母猪比农场2、5和6(分别为30%、44%、50%)具有更高的阳性率和病毒载量(图1A)。病毒血症水平在母猪间具有高度变异性,胎次(数据未显示)和母猪疫苗接种状态(图1)均与病毒血症水平无关。在超过95%的PCV2感染母猪中观察到PCV2b亚型。
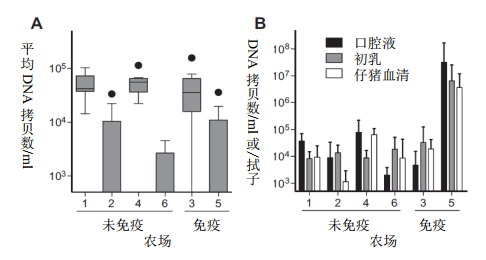
图1 母猪和仔猪体内的PCV2病毒。从(A)母猪血清、(B)初乳、口腔液和哺乳前仔猪血清中分离PCV2 DNA。使用SYBR green qPCR试验测定是否存在PCV2 DNA。根据标准曲线测定病毒拷贝数,并以每毫升血清或初乳或每份口腔拭子表示,PCV2阳性样本的临界值为500 DNA拷贝数/ml或250 DNA拷贝数/拭子。(A)箱须图采用Tukey法测定须线。
所有母猪,无论PCV2病毒血症状态如何,均具有高水平的PCV2特异性IgG,其中实行疫苗接种的农场母猪在所有动物中均表现出高水平的抗体(图2A)。而病毒血症与血清中抗体水平无明显相关性(Spearman相关,rs = -1.16,p = 0.22)。初乳中,存在高水平的PCV2特异性IgG,尤其是接种母猪(2B),并与血清中抗体水平有相关性(rs = 0.85,p
< 0.0001)。初乳中也存在PCV2特异性IgM和IgA抗体,但水平相对很低(图2B)。母猪口腔液含有低水平的PCV2特异性IgG和IgA,以及不可测量的IgM(数据未显示),在第1天和第3天样本之间未观察到显著差异。粪便中未检出PCV2特异性抗体。虽然在研究中59头母猪的血清中均检测到PCV2抗体,但通过PCR检测,仅73%的母猪为PCV2阳性。值得注意的是,抗体水平最高的农场5母猪的排毒量也是最高的(图2A与图1B)。这些观察结果表明,PCV2在高水平抗体应答的情况下依然会持续存在,并再次表明单独病毒血症不会引起疾病。
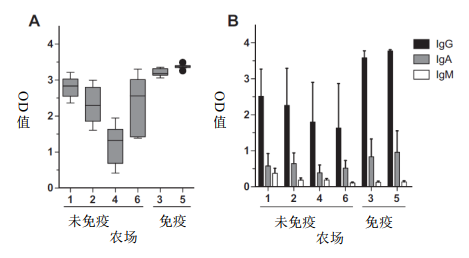
图2 母猪血清和初乳中的PCV2抗体。ELISA检测母猪(A)血清中PCV2特异性IgG抗体和(B)初乳中IgG、IgA、IgM抗体。样品按1:50(血清、初乳IgA和IgM)或1:5000(初乳IgG)和二抗1:100000(血清)和1:25000(初乳)稀释。OD值>0.1视为抗体阳性。(A)箱须图采用Tukey法测定须线。
2、母猪排毒
76%的母猪初乳和80%的口腔液PCR检测PCV2为阳性,但动物个体间和养殖场间水平差异很大(图1B)。免疫接种对经口或乳房散毒程度无影响。事实上,在疫苗加强操作的农场5母猪中观察到最高水平的PCV2。粪便散毒也很常见,42%的样本为阳性。
3、PCV2对环境的污染
母猪通过分泌和排泄物大量散毒,提示仔猪饲养环境受到严重污染。毫不奇怪,无论母猪接种状态如何,在整个仔猪饲养环境中都很容易检测到PCV2 DNA(图3,数据未显示)。
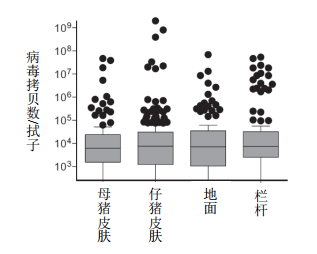
图3 产仔环境中的病毒。从母猪和新生仔猪的腋窝间隙,以及笼底和笼栏中分离出PCV2 DNA。使用SYBR green qPCR试验检测是否存在PCV2 DNA。根据标准曲线确定病毒拷贝数,PCV2阳性样本的临界值为250 DNA拷贝数/拭子。箱须图采用Tukey法测定须线。
对农场1和2中的空产房高压清洗后采样,并分别用Synergize(Preserve International, Reno, NV)或Virkon-S(DuPont, Wilmington, DE)消毒处理后再次采样。采用Synergize清洗和消毒程序后,对农场4的产房进行采样。无论有无高压洗涤,均容易检测到高水平的PCV2 DNA,消毒后检出量均降低但未消除(图4)。
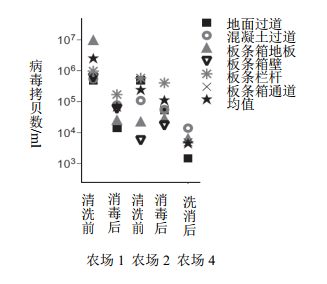
图4 产房内的病毒。使用swiffer-type布沿每个样品区域擦拭对3个农场的空产房进行采样。从样品中分离PCV2 DNA,并使用SYBR green qPCR试验检测病毒存在。在高压清洗和消毒后对农场1和农场2进行采样。在清洗和消毒程序后对农场4采样。农场1和4使用Synergize消毒剂,农场2使用Virkon-S。
4、仔猪感染PCV2
281头仔猪中63%的仔猪哺乳前血清PCV2阳性,表明存在广泛的子宫内感染(图1B)。在超过93%的仔猪中观察到PCV2b亚型。母猪胎次(p > 0.37)或母猪病毒血症(p > 0.77)对仔猪病毒血症无影响。然而,来自非病毒血症母猪的仔猪通常具有较低或检测不到的病毒血症水平,而来自病毒血症母猪的仔猪检测到不同水平的DNA。有趣的是,除1头PCR阴性母猪外,所有母猪均至少产下1头病毒血症仔猪,表明血清PCR不能用于鉴定PCV2阴性状态。母猪可能出现低于PCR检测限度的病毒血症,或可能在无病毒血症的部位发生病毒复制。事实上,除农场2中的1头外,所有非病毒血症母猪的口腔液、初乳或粪便中均为PCV2阳性。PCV2特异性抗体检测发现,5%的哺乳前仔猪血清样本为阳性,而先前观察到的为21%(Shen et al., 2010)。此外,已经观察到,在妊娠 > 70天即免疫活性开始,感染的仔猪含有PCV2 DNA和抗体(Nielsenet al., 1991),而在妊娠57天时,感染的胎仔不含PCV2抗体(Sanchezet al., 2001)。结合我们的数据,即便初生仔猪为PCV2血清阴性,实际上大多数仔猪在胎仔发育早期已经自然感染PCV2。
采集新生仔猪前肢内部的腋窝皮肤拭子(出生后不太可能立即受到环境污染的位置),以评估仔猪在产道中暴露于PCV2的情况。93%的皮肤标本为阳性,病毒量差异较大(图3)。初产母猪产下的仔猪皮肤表面PCV2水平高于经产母猪产下的仔猪(p
< 0.0002),但仔猪皮肤和母猪皮肤PCV2水平之间无相关性。事实上,在PCV2阴性皮肤拭子母猪产下的仔猪上观察到阳性样本,反之亦然,表明腋窝皮肤样本上未被其他部位的PCV2污染。母猪血清和仔猪皮肤上的PCV2水平相关(rs = 0.327,p< 0.0001),子宫液和仔猪皮肤上的PCV2水平也相关(rs = 0.325,p< 0.0001),进一步表明新生仔猪皮肤上的PCV2来源于分娩过程中的母猪子宫环境和生殖液。与该解释一致,48%无病毒血症母猪产下的仔猪皮肤拭子为阴性,另外45%在或接近PCR检测下限。
木乃伊胎和死胎也含有PCV2,67%样本显示高水平PCV2 DNA(数据未显示)。在检查的所有组织样本中均检测到病毒核酸,肺、肝和扁桃体中的病毒含量最高(图5,数据未显示)。不同农场间死胎中PCV2 DNA的检出量不同,农场5是母猪中PCV2抗体水平和病毒含量最高的农场。在出生后3天内死亡的弱仔中,36%的仔猪胸腔液和脾脏中存在PCV2。脾脏是在弱仔中唯一检测到PCV2的组织。
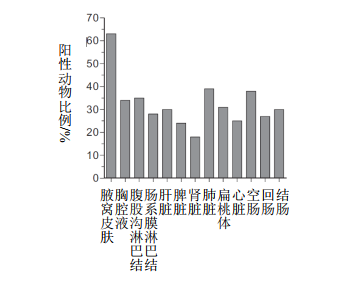
图5 死胎中病毒情况。从死胎的腋窝间隙、胸腔液和11种不同组织中分离PCV2 DNA。使用SYBR green qPCR试验测定是否存在PCV2 DNA。确定阳性样品仔猪的百分比。
5、存在PCV2活病毒
使用VR1BL细胞进行PCV2病毒分离,证实PCR检测到感染性病毒。母猪血清、母猪皮肤拭子、仔猪血清、母猪口腔液、胎盘、宫腔积液和死胎组织样品经6次盲传后用流式细胞仪和荧光显微镜筛选的细胞进行免疫荧光染色证明PCV2生长(实例见图6)。消毒前后未从初乳、木乃伊胎样品或环境室表面分离到活病毒。未确定阴性结果是由于样本中不存在感染性病毒、存在抑制或中和因子还是由于PCV2分离困难所致。这些结果并不意外;先前3种类型样品的1种中分离到感染性病毒,但猪口服后均具有感染性(Opriessnig et al.,2009)。
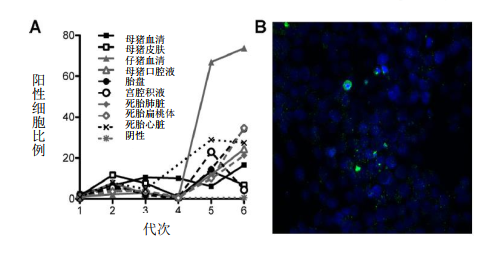
图6母猪、仔猪、环境样品中PCV2病毒的生长情况。选择PCV2阳性样本在VR1BL细胞上生长,并盲传6次。每次传代后,通过FACS分析测定PCV2阳性细胞的百分比。6次传代的FACS数据见(A),第6代出现病毒生长。使用第6代的上清液感染VR1BL细胞,并通过免疫荧光法测定是否存在感染性病毒感染(B,第6代仔猪血清)。
6、遗传分析
从病毒含量高的的样本中共获得73个基因序列(GenBank ID KC767184-KC767256)。根据我们实验室的PCV2b菌株,编号为GenBank ID JF290418,检测的641个碱基序列跨越ORF1-Rep的最后24个氨基酸(碱基921–992)、包括ORF1和ORF2终止密码子的37个非编码碱基(993–1035)和ORF2衣壳的最后177个氨基酸(1036–1566)。56个序列来自农场5的6头母猪、对应的仔猪和房间表面,另外17个序列来自其他农场。观察到16个核苷酸差异,其中7个出现氨基酸替换(表2)。在多个农场的序列中,观察到在衣壳编码区的1516和1132位碱基出现突变(表2)。农场内或农场间母猪之间或其其对应仔猪间无一致的突变模式。使用样本序列的586个核苷酸(碱基972-1557)以及代表性病毒创建树状图。6个养殖场的所有病毒样品在遗传上密切相关,聚集在PCV2b基因型1A分支上(Olveraet al.,2007;Segales et al.,2008)(图7)。在F5S7Placenta和F4S1Serum 2个样本之间之间观察到最大数量的碱基变化为6(1.0%差异)。
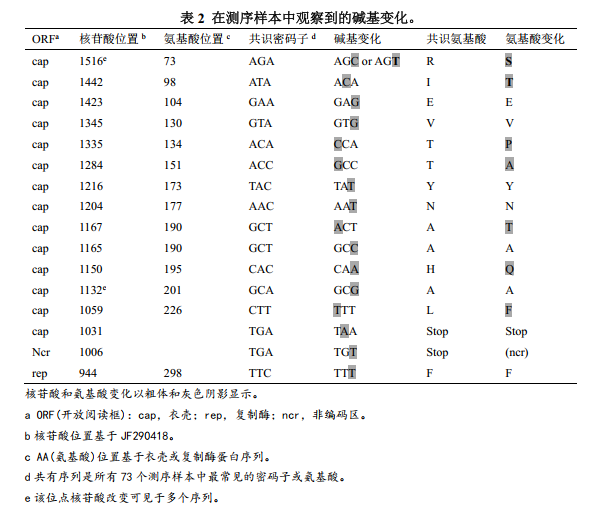
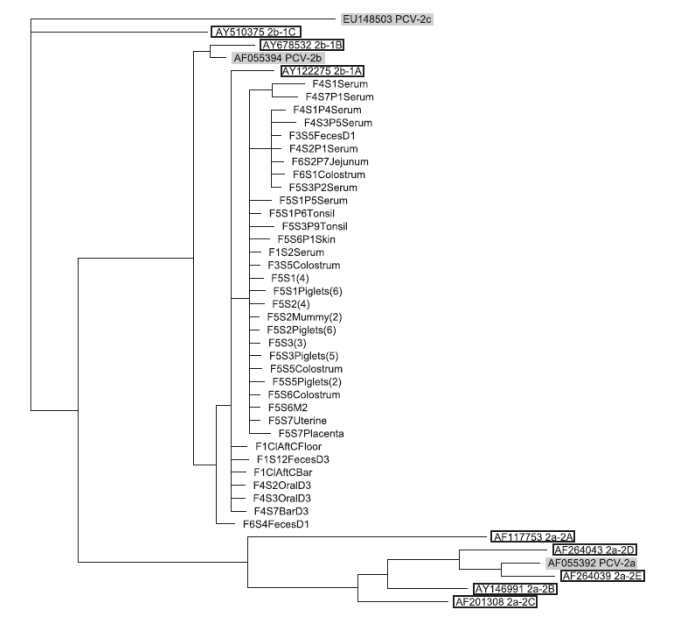
图7部分ORF2序列的系统进化分析。对选择的阳性PCV2 DNA样本进行测序,并使用Geneious Pro软件与MrBayes方法构建系统进化树。代表性病毒用灰色阴影表示,代表不同分支的序列用黑色方框表示。本研究中确定的序列标识符显示为#(#为F代表农场编号、为S代表母猪编号、为P代表仔猪编号)、样本类型和样本数量。洁净室样品由F1ClAf(消毒后的洁净室)指定,然后是样品区。
四、讨论
20世纪90年代,PCV2在全球范围内成为一种严重的猪病原体。2005年前后,随着疫苗的使用,PCVAD得到有效控制,但疫苗接种并不能消除感染。需要PCV2感染和免疫的实验模型来更好地了解PCVAD控制的免疫学基础,阐明更有效的预防和消除感染的机制,并测试新的治疗和预防方式。然而,与现代猪生产实践相关的模型需要纳入宿主-病原体相互作用的自然特征,包括感染开始和感染时的免疫状态。这些细节对于PCV2至关重要,因为即使面对强烈的免疫应答,感染似乎仍持续存在(Opriessnig et al.,2010b;Prickett et al.,2011;Puvanendiran et al.,2011;Rodriguez-Arrioja et al.,2002)。
对自然农场环境中猪的研究表明,PCV2抗体存在于母猪血清、初乳、常乳中,偶尔也存在于哺乳前仔猪血清中(Gerber et al.,2011;Grau-Roma et al.,2009;Shen et al.,2010)。在母猪、育成猪和新生仔猪血清中检测到PCV2 DNA,并经母猪分泌物散毒(Gerber et al.,2011;Grau-Roma et al.,2009;Patterson et al.,2011;Puvanendiran et al.,2011;Shen et al.,2010)。尽管PCV2在环境中稳定,但其在分娩箱环境中的存在尚不清楚(Welch et al.,2006)。在实验环境中,母猪接种可提高母猪抵抗性能并诱导仔猪保护,但尚不清楚其对商业农场环境中PCV2传播的影响(Madson and Opriessnig, 2011;Madson et al., 2009)。实验表明,母猪接种疫苗不能预防PCV2的垂直传播,也不能消除初乳中的病毒,但可诱导提升血清和初乳中PCV2抗体水平(Madson et al.,2009)。在这里,我们发现,在存在大量水平的PCV2衣壳IgG抗体的情况下,即使在采取空气过滤以除去空气传播病毒的高健康农场,所有胎次的母猪均感染PCV2。

由于PCV2是一种无囊膜病毒,令人惊讶的是衣壳抗体不能提供清除性免疫。此外,还证实了育成猪中PCV2的DNA和抗体广泛性的共存(Gerber et al., 2011;Puvanendiran et al., 2011;Shen et al., 2010)。从血清、体液和组织的细胞培养物中的分离出活PCV2表明,抗衣壳抗体的存在并不能阻止允许病毒对细胞的感染。所有这些观察结果表明,PCV2感染确实是持续性和终生性的。对两个农场的妊娠晚期母猪接种疫苗,使得分娩时抗体水平一致偏高,但不影响母猪的病毒载量或病毒向仔猪的传播。这些观察结果进一步证明了PCV2抗体与抗感染保护作用之间不存在关联,并强调需要建立相关的实验模型来进行猪PCV2感染的免疫学方面的研究。
尽管先前观察到哺乳前仔猪存在病毒血症,但仔猪病毒血症的高频率性以及母猪病毒血症与仔猪皮肤水平之间存在相关性(表明垂直传播和子宫内感染)是出乎意料的(Shen et al., 2010)。然而,如我们和其他人所示(Segales et al.,2005;Shibata et al.,2006),即使仔猪未在子宫内感染,其也会持续暴露于母源病毒,从产道开始,随后暴露于初乳、乳汁和口鼻分泌物中。PCV2也普遍存在于环境中,并且其流行率不会因母猪接种疫苗而降低。因此,新生仔猪易通过多种途径感染,包括妊娠70天前的子宫内感染、出生期间、哺乳期间、通过接触母猪及其分泌物和产仔环境等途径。

PCV2感染被广泛认为发生在8-10周龄左右,此时母源免疫力已经减弱,并且在PCVAD出现之前(Carasova et al.,2007;Rodriguez-Arrioja et al.,2002;Segales et al.,2012)。据推测,母猪血清中存在的高水平PCV2抗体通过初乳转移至仔猪,可预防仔猪感染,并且当母源免疫力减弱时,仔猪容易感染。然而,我们的数据支持通过直接母胎方式或仔猪环境获得性感染的垂直传播模型,部分模型是由转移到初乳和常汁中的母源抗体控制的。因此,疾病直到母源免疫力下降后才表现出来。该模型得到了以下证据的支持:免疫母猪可预防PCVAD,但不能预防PCV2感染(Calsamiglia et al., 2007;Madson and Opriessnig, 2011;McKeown et al., 2005)。
木乃伊胎和死胎组织中广泛存在PCV2,表明PCV2感染是广泛性的,可能导致胎儿无法存活。有趣的是,PCV2仅在弱仔猪的脾脏中发现,表明尚未建立广泛性感染,并且母源抗体可能限制病毒感染。仔猪早期的暴露和感染是否由母猪免疫被动控制,或感染是否被掩盖直至断奶后母源保护减弱,仍有待研究确定。
各阶段病毒载量和PCV2抗体水平的定量分析研究显示,主动和被动免疫不能有效预防或控制猪的PCV2感染,导致终生感染和PCVAD易感性。PCV2疫苗预防疾病的能力表明,疫苗诱导的免疫在性质上不同于自然免疫。所有PCV2疫苗均由细胞培养物或非复制型灭活病毒制剂中表达的衣壳蛋白组成,一般认为其通过刺激抗体应答发挥作用。由于抗体应答性质的细微差异或T细胞应答的差异,阐明疫苗与自然感染引起的抗PCV2免疫差异可能有助于解释疫苗的有效性。此外,我们在此表明,几乎总是在出生后断奶前后进行的疫苗接种,是发生在仔猪既往暴露于病毒后,甚至可能是病毒活动性感染时。因此,用于阐明PCV2感染中免疫保护机制的模型必须考虑到这一特征。特别是,需要体内模型来解决在幼龄感染猪中诱导适应性免疫应答、母源抗体传递在免疫诱导中的作用以及感染时间和剂量对免疫结果的动力学问题。最近还发现了PCV2感染VR1BL细胞的体外模型,该模型有可能模拟急性和持续感染的细胞内抗病毒反应(Dvorak et al.,2013)。
五、结论
PCV2感染发生在生命早期,主要发生在胎儿发育期间的子宫内,或出生期间和出生后不久存在大量PCV2的母猪、初乳、常乳以及产仔环境中。抗PCV2抗体存在于初乳和口腔液中,但不影响仔猪的病毒血症水平。仔猪PCV2感染不受母猪胎次、母猪病毒血症水平、母猪免疫力水平、母猪先前接种疫苗或养殖场健康状况的影响,表明母猪PCV2感染呈持续性。我们的研究结果表明,仔猪在接种疫苗前已经感染PCV2。了解自然感染的发生将有助于开发反映猪群中PCV2感染动力学的实验性免疫模型,并使未来的疫苗开发成为可能。
最新发布