
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的一种传染性肠道疾病,可造成猪群暴发腹泻和初生仔猪大量死亡。2010 年,高致病性的 PEDV 变异毒株出现并在全球范围内传播,已成为当 前猪腹泻病的主要病原之一,对全球养猪业造成巨大损失。
疫苗免疫是防控 PED 的最主要 措施。现有 PED 商品化疫苗以传统灭活疫苗和弱毒疫苗为主。近年来,随着基因工程技术 的发展,亚单位疫苗、病毒样颗粒疫苗、重组活载体疫苗、转基因植物疫苗和核酸疫苗等 的研究也都取得了突破性进展。由于 PEDV 变异频繁,不断给疫苗研发带来新的挑战,高效的疫苗研发平台及基因工程疫苗对未来 PED 防控至关重要。本文对 PEDV 的病原学特征和最新的疫苗研究进展进行了系统综述,并展望未来的疫苗发展方向,以期为有效防控 PED 提供参考依据。
关键词:猪流行性腹泻;猪流行性腹泻病毒;灭活疫苗;弱毒疫苗;基因工程疫苗;核酸疫苗
1 PEDV 基因组与 S 蛋白特征
PEDV 属于冠状病毒科α冠状病毒属,是有囊膜的单股正链 RNA 病毒。病毒粒子近似球形,粒子直径为130-170 nm,表面由棒状突起覆盖。基因组全长约为28 kb,包含 5’帽 子结构、3’poly (A)尾和7个开放阅读框(open reading frame,ORF)。其中ORF1a和ORF1b占据基因组的2/3,编码非结构多聚蛋白1a和1ab,这两种多聚蛋白在3C样蛋白酶 和类木瓜蛋白酶的作用下裂解为16种非结构蛋白(nonstructural protein,nsp);另1/3基因组主要编码4种结构蛋白,分别为棘突蛋白 S、包膜蛋白 E、囊膜蛋白 M 和核衣壳蛋白N。
S蛋白是一种位于病毒表面的糖蛋白,通过与宿主细胞上的特异性受体结合介导病毒的入侵,并与病毒的组织或宿主嗜性相关。S蛋白由两个亚基组成,分别是外部的S1亚基和内部的S2亚基。S1亚基由N端信号肽、N末端结构域和C末端结构域组成,负责与宿主细胞受体的结合。S2亚基由胞外结构域、跨膜结构域和胞内结构域组成,负责介导病毒与宿主细胞膜的融合;其中,S2亚基的胞外域包括蛋白酶切割位点、融合肽和两个七肽重复区。S蛋白是PEDV重要的免疫原性蛋白,目前已经发现六个中和表位S10(aa 19– 220)、S1A(aa 435–485),COE(aa 499–638)、SS2(aa 748–755)、SS6(aa 764–771)和 2C10(aa 1368–1374)。因此,S 蛋白常被作为PEDV疫苗设计的关键靶点。
根据对PEDV S基因的遗传进化研究,PEDV毒株可分为GⅠ型和GⅡ型,其中GⅠ型又分为GⅠa和GⅠb亚型,GⅡ型又分为GⅡa和GⅡb亚型。当前我国优势流行毒株为GⅡ变异型。 2014年,美国首次分离到一株低致病性 PEDV-OH851 株,与其它 PEDV 流行毒株的S基因相比,OH851株的S基因有3个缺失(167位1nt缺失,176位11nt缺失,416位3nt缺 失),1个插入位点(474-475位之间6nt插入),S1区前1170nt有多个突变,这种新出现的毒株被命名为“S-INDEL”毒株。
2 PEDV 商品疫苗概况
2.1 PEDV 国内商品疫苗概况
2015年3月24日,由中国农业科学院哈尔滨兽医研究所研制的猪传染性胃肠炎病毒 、猪流行性腹泻病毒、猪轮状病毒三联活疫苗正式发布,这是中国大陆第一个猪腹泻病毒三联疫苗,能够同时预防三种主要的猪病毒性腹泻疾病。目前,国内已有30余家生产企业获得 PEDV 疫苗的生产批准文号,其中以生产TGEV、PEDV 二联疫苗居多,毒株以经典毒株CV777为主,但使用G群经典毒株CV777研制的疫苗可能无法针对当前流行的GⅡ群毒株提供很好的免疫保护力,因此,近几年也陆续发布了针对AJ1102株(2017年首次批签发)、SCSZ-1株(2018年首次批签发)、LW/L株(2018年首次批签发)、XJ-DB2株 (2021年首次批签发)和CHYJ株(2023年首次批签发)等变异流行毒株的PEDV商品疫苗。PEDV主要感染肠道上皮细胞,通过胃肠道免疫激发乳腺分泌sIgA抗体,仔猪通过初 乳摄取sIgA抗体后可以获得针对PEDV的被动免疫保护,因此诱发有效的黏膜免疫是预防仔猪感染 PEDV 的关键。2023年,由海大集团发布的海泻康-猪流行性腹泻灭活疫苗(CHYJ 株)成为国内首个获批的腹泻类黏膜免疫疫苗,其推荐免疫方式为滴鼻免疫,突破了以往的注射免疫方式,为未来的PEDV疫苗研究提供了新的方向。2024年国内批签发的PEDV 商品疫苗种类包括猪传染性胃肠炎、猪流行性腹泻二联灭活疫苗;猪传染性胃肠炎、猪流行性腹泻二联弱毒疫苗;猪传染性胃肠炎、猪流行性腹泻、猪轮状病毒三联弱毒活疫苗和猪流行性腹泻灭活疫苗,采用的毒株包括PEDV经典毒株(CV777 株、ZJ-08 株)和变异毒株(AJ1102-R 株、SCZ-1 株、LW/L 株、XJ-DB2 株、CHYJ 株)(表 1)。
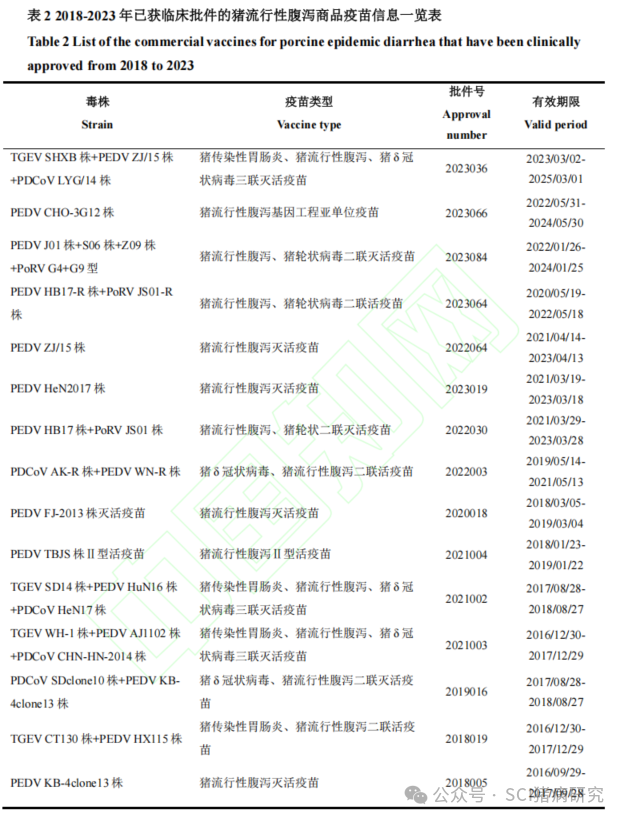
2018-2023年已获临床批件的疫苗数据表明(表 2),相比过去主要围绕猪传染性胃肠炎、猪流行性腹泻二联疫苗进行研发与生产,目前关于 PEDV 商品疫苗则主要围绕猪传染性胃肠炎、猪流行性腹泻、猪 δ冠状病毒三联灭活疫苗和猪流行性腹泻、猪轮状病毒二联灭活疫苗进行研发,所采用毒株已全部为 PEDV 流行变异毒株,这与当前临床病毒性腹泻的流行现状高度契合。亚单位疫苗具有便于规模化生产、安全性高、稳定性好的优点,首个由CHO细胞表达的PEDV S蛋白亚单位疫苗CHO-3G12株也已进入临床审批阶段。近几年获临床批件的PEDV相关疫苗类型代表了未来商品化猪腹泻疫苗的主要趋势,相信在未来能够为防控猪病毒性腹泻疾病提供更有力的保障。


2.2 国外商品疫苗概况
韩国于 1992年首次报道PEDV,此后PED在其许多省份流行,成为韩国最重要的猪病毒性腹泻疾病之一,并造成重大的经济损失。为了防控PED,韩国第一种基于GⅠa型PEDV毒株SM98-1的灭活疫苗在2004年上市。该毒株还通过在细胞中连续传代培养致弱,用于制作弱毒疫苗。此外,韩国研究人员通过将分离得到的PEDV毒株在 Vero细胞中连续传代获得GⅠa型PEDV减毒株KPEDV-9和DR-13并制成弱毒疫苗,两种疫苗的免疫途径分别为肌肉接种免疫和口服免疫。而在日本,研究人员将 GⅠa 型PEDV毒株83P-5 在Vero细胞中传代100次后制成弱毒疫苗(P-5 V),该疫苗在日本和韩国被广泛使用。2013年春季,美国确认了一种PEDV GⅡb变异株,该毒株导致的疫情暴发在一年内导致新生仔猪大量死亡。随后,该毒株迅速传播到美洲、欧洲和亚洲国家,在世界范围内引发了第二波 PED 流行。由于PEDV GⅠa型经典毒株生产的疫苗无法对GⅡb型变异毒株提供良好的保护效果,因此,GⅡb型 PEDV毒株被认为是开发下一代疫苗的关键。2014年6月,美国批准了一款用于紧急接种的 PEDV mRNA疫苗(PED-RP)。同年9月,由硕腾公司开发的PEDV全病毒灭活疫苗上市。同时,韩国还开发了由韩国分离株KNU-141113S-DEL5/ORF3生产的GⅡb口服活疫苗,并于2020年起投入猪场使用,该疫苗也是全球首个PEDV GⅡb口服弱毒疫苗。
3 PEDV传统疫苗研究现状
3.1 灭活疫苗
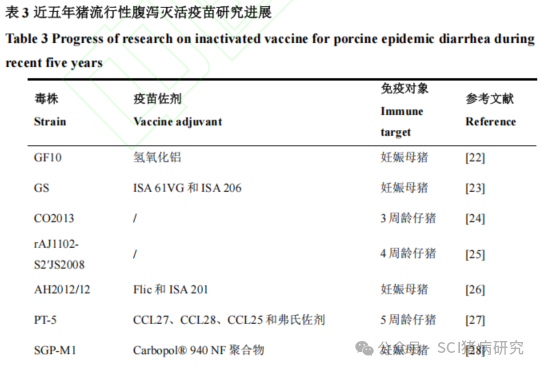
早期的 PEDV 灭活疫苗是将病猪的小肠组织处理并灭活后加入佐剂制成,也称为组织灭活疫苗。中国最早报道的 PEDV 灭活疫苗就是 1993 年由王明等用 PEDV 沪毒株攻毒后取发病仔猪的肠组织悬液制成的氢氧化铝组织灭活疫苗。PEDV 组织灭活疫苗的制备方法较为简易,且具有较强的病原针对性;但通常难以确定组织中的病原含量,并含有很多异源物质和不确定因素,不易于大规模生产。相比之下,以病毒的细胞培养物制成的细胞灭活疫苗质量可控,还能基于细胞悬浮培养技术实现大规模生产,发展前景更为广阔。近五年在猪体内进行过动物试验的猪流行性腹泻灭活疫苗研究如表3所示。常小云等利用悬浮培养技术将PEDV GF10变异株制备成灭活苗免疫妊娠母猪,结果表明该疫苗对于仔猪的保护率高达90%,且仔猪获得的母源抗体可持续至 35日龄以上。郭振刚等用PEDVGS毒株细胞灭活苗免疫妊娠母猪,所产7日龄仔猪的母源抗体中和效价在1:128~1:256之间,并且可持续至28日龄左右。为简化疫苗开发工艺,Singh等将 PEDV CO2013毒株在44℃条件下热处理10 min以展开结构蛋白,随后用RNAse使基因组片段化,最后在25℃下重新折叠衣壳蛋白以制备 PEDV 灭活苗,免疫 3 周龄仔猪可以提供针对 PEDV 强毒株的保护作用。使用胰蛋白酶依赖性的PEDV毒株作为疫苗毒株会使疫苗制备过程更复杂,并增加疫苗生产的成本。Li等利用相应的PEDV JS2008毒株(非胰蛋白酶依赖型PEDV G毒株)序列替换PEDV AJ1102毒株(胰蛋白酶依赖型PEDV GⅡ毒株)的S2结构域(aa894-1386),生成重组毒株 rAJ1102-S2′JS2008。rAJ1102-S2′JS2008可以独立于胰蛋白酶进行稳定传代,灭活后对4周龄仔猪进行三次肌肉注射可以诱导仔猪同时产生针对AJ1102和JS2008毒株的中和抗体。
灭活疫苗具有安全性高、便于贮存和运输及生产工艺成熟等优点,但其免疫效果较差,无法诱导细胞免疫,需要多次接种才能达到持久的免疫效果。因此,灭活疫苗通常需要适当的免疫增强剂。Xu等将PEDV AH2012/12毒株灭活后添加Flic佐剂制成灭活疫苗,对妊娠母猪间隔14d进行两次滴鼻免疫后,母猪血清和初乳中均产生了高水平的IgG、IgA和中和抗体,仔猪存活率提升了 73.34%。Hsueh等使用PEDVPT-5毒株制成灭活疫苗后对5周龄仔猪进行肌肉注射,与未添加佐剂的灭活疫苗相比,使用 CCL蛋白作为佐剂的灭活疫苗可诱导更高水平的特异性IgG和sIgA抗体。Choe 等用 PEDV SGP-M1 毒株混合Carbopol® 940NF聚合物制成灭活疫苗,在妊娠母猪分娩前5周和2周各皮下接种1次,可保护所产仔猪免受强毒株的攻击,仔猪存活率为70%。建立肠黏膜免疫反应包括病毒特异性IgA的分泌,是预防PEDV感染的关键。Zhang等研究发现,与口服免疫相比,滴鼻免疫PEDV灭活疫苗后仔猪肠道内中和抗体水平更高,表明滴鼻免疫在诱导肠黏膜免疫反应方面更有效,是一种很有潜力的灭活疫苗接种方式。

3.2 弱毒疫苗
PEDV弱毒疫苗是指将PEDV强毒株的毒力和致病性降低后制备而成的疫苗,如何将强毒株致弱的同时保留其免疫原性是弱毒疫苗研究的关键。传统的致弱手段是通过在细胞中连续传代而获得PEDV弱毒株。近五年在猪体内进行过动物试验的猪流行性腹泻弱毒疫苗研究如表4所示。Jang等将强毒株KNU-141112在Vero细胞中连续传代,获得了弱毒株S DEL5/ORF3作为疫苗候选毒株。妊娠母猪口服弱毒活苗并在分娩前加强免疫两次市售灭活疫苗后,所产仔猪的存活率从0%提高到100%,腹泻程度显著减轻。Schumacher等将PEDV IL20697毒株在Vero细胞中连续传代并纯化后得到减毒株,母猪妊娠79d时口服免疫,100d时加强免疫,结果母猪与新生仔猪均产生了高水平的特异性IgG和sIgA抗体;与对照组相比,仔猪存活率显著提高,但在仔猪粪便排毒方面没有明显差异。为了降低细胞连续传代而带来的时间和经济成本,Won等通过降低Vero细胞的生长温度,对PEDV Aram-P5强毒株进行短期传代,从而获得了一种冷适应的低传代弱毒株Aram-P29-CA。临床试验表明,给仔猪接种该毒株后并没有出现腹泻、呕吐等症状,表明该毒株在正常体温下不会返强;将Aram-P29-CA 免疫妊娠母猪后,在母猪的初乳中检测到较高的抗体水平,并显著提高了仔猪存活率。Kim等将分离的GⅡb型PEDV毒株在各种培养条件下连续传代,包括在培养基中补充 L-1-甲苯磺酰胺-2-苯基乙基氯甲基酮(TPCK)处理的胰蛋白酶、胎牛血清(FBS)和糖去氧胆酸(GCDCA),最终产生了六种弱毒株:CKT-7 T15(含 TPCK 处理的胰蛋白酶)、CKT-7 T15N(含 TPCK 处理的胰蛋白酶和 GCDCA)、CKT-7 N(含 GCDCA)、CKT-7 NF(含 GCDCA 和 FBS)、CKT-7 F(含 FBS)和 CKT-7X(无补充剂),并基于此来制备弱毒疫苗。动物试验结果显示 CKT-7 N 毒株的病毒滴度最高,峰值约为(8.67 ± 0.29)lg TCID50·mL−1,且在5日龄仔猪中未观察到死亡或腹泻症状,表明CKT-7 N 株为最适合的候选疫苗毒株。
随着 PEDV 基因组信息增多,利用基因工程技术敲减或敲除毒力基因获得弱毒株正成为 PEDV 弱毒疫苗的研究热点。与传统方法相比,该技术的安全性更高、研发过程更高效、生产工艺更简便。Hou 等通过抑制nsp16的2′-O 甲基转移酶的活性并同时敲除S蛋白胞内域的内吞信号序列,设计了PEDV KDKE4A-SYA重组弱毒株,该毒株感染细胞可以诱导更强的I型和III型干扰素反应,免疫妊娠母猪后对新生仔猪的保护率可达100%,表明nsp16蛋白可以作为开发PEDV弱毒疫苗的通用靶标。Deng等通过使PEDV中的干扰素11拮抗蛋白nsp1、nsp15和nsp16失活得到了弱毒株icPEDV-mute4,仔猪感染该毒株后未表现相关症状,并且诱发了针对PEDV的IgG中和抗体反应,为研制 PEDV 弱毒疫苗提供了新的方向。冠状病毒S蛋白的N-糖基化位点突变是影响哺乳动物冠状病毒感染,传播,致病性和免疫原性的关键因素。Zhang等通过用天冬酰胺氨基酸替换aa514和aa556 位点的丝氨酸,生成了三种重组PEDV,分别命名为r12-N514G、r12-N556G和r12-N514+556G。与亲本病毒相比,重组病毒可以诱导5日龄仔猪产生高水平的sIgA和IgG抗体,抗体滴度在12 dpi 时达到峰值水平,其原因可能是去除糖基化位点会暴露S蛋白的抗原表位,以削弱病毒对宿主免疫反应的逃逸能力,但重组PEDV仍会引起组织病变,其安全性还有待考量。
与PEDV灭活疫苗相比,弱毒活疫苗具有更好的免疫原性,能够有效刺激肠道黏膜而产生黏膜免疫,并可以长期保持免疫效果,减少多次接种带来的猪群应激。但弱毒活疫苗的保存和运输条件较为严格,并具有返强风险。针对2010年后出现的PEDV变异毒株,基于经典毒株制备的商品化疫苗可能无法提供理想的保护效果。因此,基于基因工程的PEDV 新型疫苗研究正成为热点。

4 PEDV基因工程疫苗研究现状
4.1 亚单位疫苗
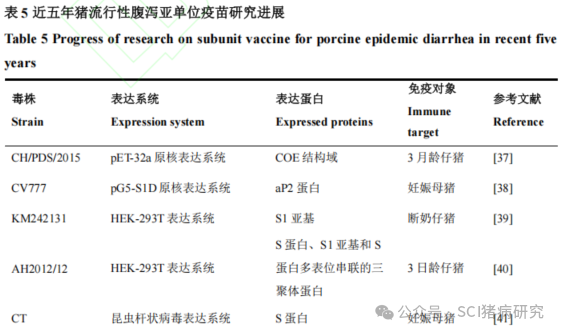
PEDV亚单位疫苗是指将PEDV的结构/非结构蛋白克隆于特定的表达系统,实现体外高效表达和纯化,以获得的重组蛋白作为免疫原制备的疫苗。S蛋白在PEDV入侵宿主和病毒-宿主膜融合中发挥重要作用,并且具有多个B淋巴细胞抗原表位,能够诱导机体产生中和抗体,因此S蛋白被认为是开发PEDV亚单位疫苗的重要靶标。近五年在猪体内进行过动物试验的猪流行性腹泻亚单位疫苗研究如表5所示。原核表达系统、真核表达系统及昆虫细胞-杆状病毒表达系统((baculovirus expression vector system,BEVs)是制备亚单位疫苗常用的表达系统。原核表达系统可在短时间获得大量目标蛋白,具有大规模生产的能力,但不能对病毒蛋白进行正确折叠和翻译后修饰,不利于保持蛋白的抗原活性。郭涛使用大肠杆菌pET-32a原核表达系统表达重组PEDVCH/PDS/2015株COE蛋白并制备亚单位疫苗,通过肌肉注射和口服免疫后,3月龄仔猪血清特异性IgG和唾液中的sIgA均有所升高。Choe等使用大肠杆菌 pG5-S1D 原核表达系统表达了PEDV S1亚基的可溶性aP2蛋白,并用HPMCP微球包裹蛋白,配合使用口服疫苗佐剂LLRANKL。妊娠母猪在分娩前4周和前2周进行两次口服免疫后,初乳中sIgA抗体、中和抗体均显著增加,所产仔猪的存活率与商品灭活疫苗免疫组相似。真核表达系统可表达结构复杂的目标蛋白,维持蛋白的天然空间构像,有利于诱导产生中和抗体,但存在成本较高、培养效率较低等问题。武旺盛等用慢病毒表达系统成功制备稳定表达PEDV KM242131株S1蛋白的重组 HEK-293T 细胞,与佐剂结合后制备亚单位疫苗,肌肉注射断奶仔猪,两次加强免疫后能刺激仔猪机体产生特异性sIgA抗体,唾液sIgA的S/P值最高可达0.59。Guo等成功制备稳定表达PEDV AH2012/12株全长S蛋白、S1亚基和S蛋白多表位串联的三聚体蛋白的重组 HEK-293T细胞,并使用氢氧化铝佐剂 M401和水基佐剂M103 分别制成亚单位疫苗S/M401、S1/M401、COEs/M401 和 S/M103、S1/M103、COEs/M103。小鼠实验表明S/M103免疫组小鼠的中和抗体滴度最高,为1:96,故选择S/M103亚单位疫苗在仔猪中进一步评估。3日龄仔猪肌肉接种免疫后,S/M103诱导的IgG、IgA、IFN-γ和中和抗体水平相对较高,保护效果优于商品灭活疫苗,并对GⅡa型毒株具有一定的交叉保护作用,表明S/M103具有作为临床候选亚单位疫苗的潜力。
BEVs可对目标蛋白进行恰当的折叠和翻译后修饰,从而使表达的蛋白接近天然蛋白,并且昆虫细胞可大规模悬浮培养,有利于规模化生产。吴松等利用BEVs表达了的PEDVCT株的S1蛋白并制备亚单位疫苗,免疫妊娠75 d的母猪后,在母猪的血清和乳汁中分别能检测到高水平的IgG和sIgA抗体,对仔猪的保护率为75.32%。Chang 等用家蚕核型多角体病毒(Bombyx mori NPV,BmNPV)表达PEDV PT株的S蛋白后制成亚单位疫苗,对4周龄仔猪间隔2周口服免疫3次后,不能检测到针对PEDV的特异性体液免疫反应和黏膜免疫反应,研究人员认为这可能是由于猪胃肠道的低 pH环境和消化酶酶解能力导致疫苗失活,以及疫苗未添加佐剂来克服口服耐受性,需要探究更好的策略来使口服疫苗在胃肠道递送并保留其免疫原性。Yu等用Bac-to-Bac 杆状病毒表达系统表达PEDV CO株的S蛋白后制成亚单位疫苗,新生仔猪每两周肌肉注射两剂疫苗后可在血清检测到高滴度的中和抗体,但仔猪在5周龄受到 PEDV 强毒株攻击后表现出严重的腹泻症状。结果表明该亚单位疫苗可能会诱导宿主产生针对融合后PEDV S蛋白的非中和抗体,并产生抗体依赖增强效应。
基因工程亚单位疫苗可利用体外表达系统进行蛋白大量表达,便于规模化生产,具有安全性高、稳定性好的优点;同时还可配套病原体其他蛋白作为抗原建立诊断方法,以区分亚单位疫苗免疫和野毒感染。然而,与含有完整病原体成分的疫苗相比,亚单位疫苗的免疫原性较低,通常需要佐剂辅助来增强免疫效果。Wang等在PEDV亚单位疫苗中添加复合佐剂CpG5和MF59,对30日龄的仔猪肌肉免疫后,复合佐剂组仔猪的IgG抗体滴度明显高于单独使用两种佐剂的组别,表明MF59和CpG5的佐剂组合具有协同效应,可在PEDV亚单位疫苗中产生更强烈和更持久的免疫增强反应。

4.2 病毒样颗粒疫苗
PEDV病毒样颗粒(virus-like particles,VLPs)疫苗是一种和病毒结构相似的空心颗粒,基于PEDV的一种或多种结构蛋白(不含核酸)组装而成。与亚单位疫苗相比,VLPs可以模拟病毒自然感染的过程,诱导免疫保护作用。同时,由于VLPs缺乏遗传物质,因此不存在自主复制的能力和毒力返强的风险,安全性更高。
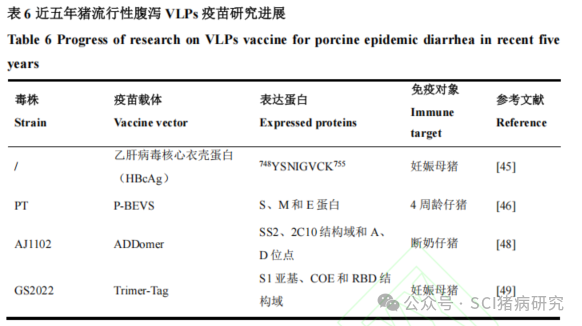
近五年在猪体内进行过动物试验的猪流行性腹泻VLPs疫苗研究如表6所示。Lu 等将PEDV S蛋白的B细胞表位748YSNIGVCK755重组到乙肝病毒核心衣壳蛋白(HBcAg)中制备VLPs,在妊娠母猪分娩前6周进行3次肌肉注射,每次间隔2周;与对照组相比,所产仔猪的攻毒后存活率提升30%,发病症状减轻。Hsu等[46]以PEDV VLPs(包含S、M 和E 蛋白)为抗原,辅以CCL25和CCL28作为佐剂,免疫4周龄仔猪后能够检测到高水平的特异性IgG和sIgA抗体,并诱导了细胞免疫。ADDomer是一种基于腺病毒多聚蛋白的纳米颗粒骨架,其与BEVs联合产生的VLPs疫苗表现出优异的免疫原性,具有巨大的开发前景。Du等同时将PEDV S蛋白的SS2和2C10结构域以及TGEV S蛋白的A和D位点插入到 ADDomer 框架中,并通过BEVS表达重组蛋白AD、AD-P、AD-T和AD-PT,随后将自组装的重组ADDomer-VLPs制备成疫苗。临床结果表明,该重组ADDomer-VLPs 疫苗能够有效刺激仔猪产生针对PEDV和TGEV的中和抗体以及Th1型和Th2型免疫反应。Trimer-Tag(蛋白质三聚体化)技术平台可以使任意一个目的蛋白三聚体化,获得稳定的类天然三聚体结构的病毒抗原,为开发VLPs提供了新的思路。该技术平台已通过新冠肺炎疫苗(SCB-2019)全面验证,SCB-2019已在中国获得紧急使用授权。Li等使用TrimerTag平台生产了PEDV GS2022毒株的S1-Trimer、COE-Trime和RBD-Trimer作为候选亚单位疫苗。妊娠母猪于产前35d和20d进行两次肌肉接种免疫,结果表明,与RBD-Trimer和COE-Trimer 相比,S1-Trimer表现出优势。S1-Trimer在妊娠母猪的血清、初乳和唾液中诱导高水平的PEDV特异性IgG和sIgA抗体,同时还诱导了细胞免疫,母猪PBMC中的IFN-γ和IL-4的表达量显著升高,所产仔猪的血清和肠道样本中均检测到高水平的IgG、IgA和中和抗体。
4.3 重组活载体疫苗
重组活载体疫苗是基于同源重组原理研发的疫苗,将PEDV编码有效抗原蛋白的基因重组到活载体的基因组中并使之表达。活载体疫苗的安全性高,生产成本低,能够激发体液免疫、细胞免疫和黏膜免疫。活载体的基因组能容纳足够的外源基因,可用于多联或多价疫苗的研制。研发重组活载体疫苗时,应注意载体安全性、外源基因表达量、重组菌/毒株遗传稳定性等问题。目前主要包括细菌活载体疫苗和病毒活载体疫苗。
4.3.1 细菌活载体疫苗
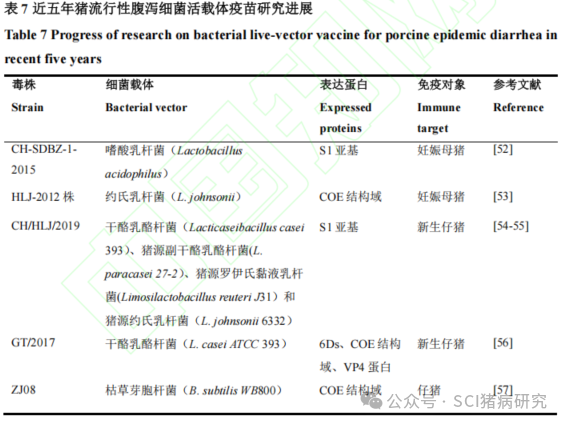
细菌活载体疫苗通常通过口服免疫,重组菌在体内可与病原体竞争肠道黏膜结合位点,起到免疫保护作用。目前常用的细菌活载体包括肠道乳酸菌和枯草芽孢杆菌。乳酸菌可以在胆汁和低pH值条件下存活,因此可以保证重组菌在通过胃肠道过程中的免疫原性。此外,乳酸菌易于通过肠道吸收,有利于产生黏膜免疫。近五年在猪体内进行过动物试验的猪流行性腹泻细菌活载体疫苗研究如表7所示。Zang等用嗜酸乳杆菌表达 PEDV CH-SDBZ-1-2015毒株的S1蛋白,构建了重组菌L. acidophilus-S1,妊娠母猪口服免疫后,初乳中特异性 sIgA 抗体水平显著升高,可为新生仔猪提供良好的被动免疫。Zheng等用约氏乳杆菌表达PEDV HLJ-2012株S蛋白的中和表位COE区,从而构建了重组菌株pPG-T7g10-COE/L.johnsonii,母猪口服免疫后在母乳中检测到高水平的PEDV特异性IgG和sIgA抗体,为仔猪预防PEDV感染提供了有效保护。马茹梦以工程菌干酪乳杆菌、猪源副干酪乳酪杆菌、猪源罗伊氏黏液乳杆菌和 猪 源 约 氏 乳 杆 菌为 宿 主 菌 , 构 建 表 达PEDVCH/HLJ/2019毒株S1蛋白的四株重组菌株并将其口服免疫新生仔猪,结果表明重组猪源L.paracasei 27-2的益生性、抗逆性、遗传稳定性和免疫应答效果均优于其他三种重组菌,为构建更为有效的乳酸菌口服疫苗提供了科学数据。Guo等用干酪乳杆菌(L. casei ATCC393)表达 PoRV 6Ds 蛋白、PEDV COE蛋白和TGEV VP4蛋白,构建了重组乳酸菌pPGT7g10-6Ds-COE-VP4/LC393,新生仔猪口服免疫后诱导了针对三种病毒的特异性黏膜免疫和体液免疫。此外,枯草芽胞杆菌作为活载体制备PEDV 载体疫苗具有安全性高、免疫效果好等优点。Wang等将PEDV ZJ08毒株的抗原表位COE 重组至枯草芽胞杆菌(B.subtilis WB800)中获得重组菌B. subtilis RC,口服免疫仔猪后显著提高了仔猪CD3+T细胞的数量和CD4+/CD8+T细胞的比率,并检测到高滴度的特异性IgG和sIgA抗体水平。
4.3.2 病毒活载体疫苗
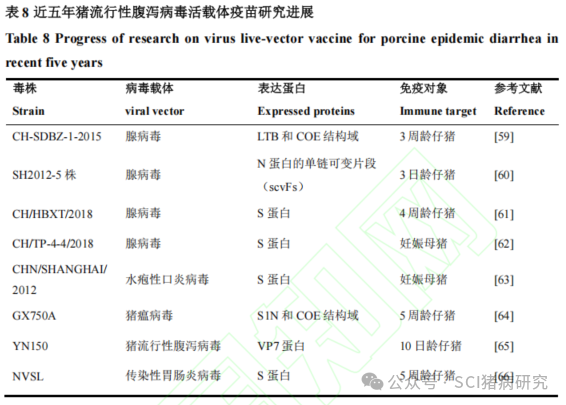
由于病毒活载体本身有助于增强免疫应答,并且可以携带多种外源基因片段,因此被认为是一种理想的疫苗研发载体。近五年在猪体内进行过动物试验的猪流行性腹泻病毒活载体疫苗研究如表 8 所示。腺病毒(adenovirus,AdV)是最常用的病毒活载体。AdV 具有非整合性的表达基因和转导能力,因此被广泛用于表达外源抗原的疫苗开发。Do等构建了编码LTB和PEDV COE的重组腺病毒rAd-LTB-COE,对3周龄仔猪进行肌肉注射或口服免疫后均可诱导高水平的体液免疫和细胞免疫。Wang等构建了表达特异性靶向PEDV SH2012-5株N蛋白的单链可变片段(single-chain variable fragment,scvFs的重组腺病毒rAdV-ZW1-16、rAdV-ZW3-21、rAdV-ZW1-41和rAdV-ZW4-16,3日龄仔猪口服免疫后显著抑制了PEDV诱导的促炎细胞因子的表达,恢复了IFN-λ的表达水平,在仔猪受到PEDV强毒株的攻击后可以起到保护作用,为后续开发基于单链抗体的疫苗提供了基础。Liu等用AdV表达PEDV CH/HBXT/2018株的S蛋白,构建了重组病毒rAd-PEDV-S,对4周龄猪进行两次肌肉注射后诱发了特异性体液免疫反应,可以在仔猪受到 PEDV 强毒株的攻击时起到保护作用,保护率为 40%(2/5)。Song等构建了表达PEDV/CH/TP-4-4/2018株S蛋白的重组腺病毒rAd5-PEDV-S,设计了在妊娠母猪分娩前5周和2周进行两次肌肉接种以及在分娩前5周进行单次肌肉接种的两种免疫程序。结果显示,通过这两种免疫程序引起的IgA、IgG和NAb 滴度的差异并不显著,这可能是因为rAd5-PEDV-S免疫的猪体内已经存在抗腺病毒的抗体,表明在分娩前5周给母猪进行单次rAd5-PEDV-S疫苗接种也可能是一种可行的免疫方案。目前,大多数 PEDV商业疫苗都推荐在母猪分娩前5周和2周进行两次免疫接种,Song等的这一发现对减少母猪免疫应激具有重要意义。
水疱性口炎病毒是一种有潜力的外源表达病毒载体,已被用作构建人用疫苗的平台。Ke等以VSV为载体表达PEDV/CHN/SHANGHAI/2012株的S蛋白,获得了重组病毒 VSVMT-SΔ19,对妊娠母猪进行2次肌肉注射后,妊娠母猪和所产仔猪(5日龄)血清中均含有针对PEDV G2b型的中和抗体;但作为活疫苗对母猪进行滴鼻免疫后在血清中没有检测到中和抗体,推测原因可能是S蛋白未在宿主细胞中表达或抗原表位未被抗原呈递细胞获取。Wang等以猪瘟病毒(classical swine fever virus,CSFV)C株表达了PEDV GX750A毒株的S1N和COE结构域,构建了重组病毒vC/SM3’UTRNCARD/tPAsS1NCOE,对5周龄仔猪肌肉接种后可诱导产生同时针对CSFV和PEDV的高免疫应答,并具有对抗CSFV和 PEDV 强毒感染的保护作用,有望在临床上达到一针两防的免疫效果,从而减少猪群免疫次数。
TGEV、PoRV和PEDV都是引起仔猪腹泻疾病的冠状病毒。Li等构建了表达PoRV VP7 蛋白的重组PEDV病毒rPEDV-PoRV-VP7,接种10日龄仔猪后,在其唾液中检测到针对PoRV VP7蛋白和PEDV S蛋白特异性 sIgA 抗体,表明该疫苗可以有效诱导黏膜免疫反应,为开发PEDV和 PoRV的二联疫苗提供了思路。Pascual-Iglesias等构建了表达PEDV-1718NVSL株S蛋白的重组TGEV病毒rTGEV-RS-SPEDV,三周龄仔猪口服接种后诱导了针对PEDV的特异性体液免疫反应,可以保护仔猪免受PEDV强毒株的攻击,但TGEV 抗体检测为阴性。
4.4 转基因植物疫苗
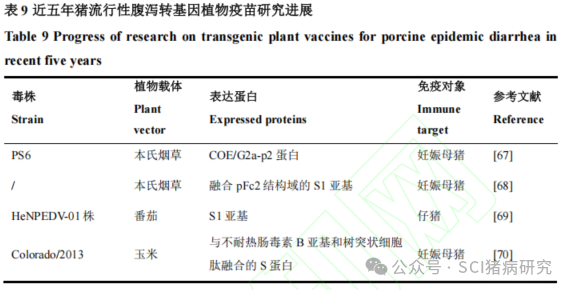
转基因植物疫苗是将PEDV主要保护性抗原基因整合到植物细胞基因组中形成转基因植物,利用植物作为生物反应器大量表达外源蛋白,将外源蛋白作为疫苗或将转基因植物直接加工饲喂动物使其获得免疫。近五年在猪体内进行过动物试验的猪流行性腹泻转基因植物疫苗研究如表9所示。Ho等用本氏烟草表达PEDV PS6株的COE/G2a-p2蛋白,肌肉注射妊娠母猪后,可在所产仔猪5日龄时检测到高水平IgG、COE-IgA、中和抗体和IFN-λ,并可以保护仔猪免受PEDV强毒株的攻击。Sohn等[68]用本氏烟草表达融合了猪Fc结构域(pFc2)的PEDV S1蛋白,妊娠母猪在产前6周和2周进行两次肌肉注射免疫,可在母猪的初乳和血清中检测到高水平的中和抗体,对哺乳仔猪的保护率达 80%。尹国友[69]将PEDV HeNPEDV-01株的S1基因导入到番茄中,给仔猪口服转基因番茄后可刺激机体产生免疫应答从而有效保护仔猪。Egelkrout等将PEDV Colorado/2013 毒株的S蛋白与不耐热肠毒素B亚基和树突状细胞肽融合后转化至玉米中,检测到目的抗原蛋白表达量可以达到20 mg·kg−1,仔猪口服转基因玉米后可产生高水平的血清中和抗体。
转基因植物疫苗具有成本低廉、稳定性好和便于贮存等优点。同时,转基因植物疫苗的抗原蛋白可作为口服疫苗或饲料添加剂,便于大规模免疫应用,具有广阔的发展前景。但是目前抗原蛋白在转基因植物中的表达量通常较低,且由于动物个体摄入量不一,免疫效果不易保障,因此未来还有待继续发展。
5 核酸疫苗
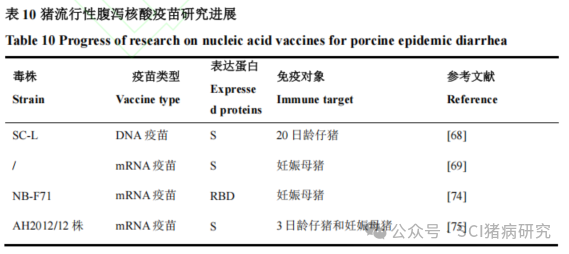
核酸疫苗是将编码 PEDV特异性抗原蛋白的外源基因(DNA或 RNA)直接导入宿主细胞内,并通过宿主细胞的表达系统合成抗原蛋白以诱导宿主产生针对该抗原蛋白的特异性免疫应答。核酸疫苗包括DNA疫苗和mRNA疫苗。现有在猪体内进行过动物试验的猪流行性腹泻核酸疫苗研究如表10所示。DNA 疫苗以质粒为载体表达抗原基因,免疫时以重组质粒的形式直接注射到宿主体内,或先将质粒转化至载体菌内,依靠载体菌将疫苗质粒导入宿主细胞。Yin等用pPI-2.EGFP载体构建了共表达PoRV VP7基因和PEDV S基因的DNA疫苗pPI-7.EGFP.VP7.S,经肌肉注射免疫小鼠后诱导了抗S蛋白和VP7蛋白的特异性免疫应答。Zhang等用鼠伤寒沙门菌(S. Typhimurium aroA)SL7207构建了共表达TGEV SC-H毒株和PEDV SC-L毒株S基因的DNA疫苗 pVAXD-PS1-TS,20日龄仔猪口服免疫后可有效刺激针对TGEV和PEDV的体液免疫、黏膜免疫和细胞免疫。相比mRNA疫苗,DNA疫苗更加稳定,制备方法也更加简单,但重组质粒具有整合到宿主细胞基因组中的风险。其次,DNA 疫苗目标蛋白的表达需要经过复制、转录和翻译等多个步骤才能产生免疫原,这导致目标蛋白的表达效率相对较低,限制了 DNA 疫苗的进一步发展。
相对于DNA疫苗,mRNA疫苗只能实现一轮感染,不具备连续感染能力,从而减少了与宿主细胞基因组整合的风险。但mRNA疫苗通常需要借助额外的载体进行递送,如脂质20纳米颗粒(lipid nanoparticles,LNPs)和复制缺陷型病毒颗粒。2014年 6 月,美国批准了一款用于紧急接种的PEDV mRNA疫苗(PED-RP),PED-RP是将 PEDV S 基因连接到pVEK载体中制备而成,pVEK是基于复制缺陷型的委内瑞拉马脑炎病毒开发的一种载体。此外,PED-RP也是美国第一个用于预防PEDV的mRNA疫苗。2020 年,在菲律宾某猪场开展了针对该疫苗的免疫效力试验,结果表明该疫苗能够促进母猪初乳和常乳中中和抗体、IgG和sIgA的产生,从而给仔猪提供有效的保护。杨利敏等选择PEDV NB-F71 毒株的RBD结构域作为疫苗靶抗原,制备了基于RBD单体和二聚体的mRNA疫苗,妊娠母猪产前7周先免疫弱毒疫苗,4周后分别免疫RBD-D mRNA候选疫苗或灭活疫苗,结果表明mRNA和灭活疫苗诱导的中和抗体平均滴度分别达到531.8和 464.8,无显著性差异,提示mRNA疫苗可诱导与灭活疫苗相近的抗体水平。Zhao等设计了用LNPs封装的mRNA(mRNA-LNP)疫苗,编码PEDV AH2012/12株的S蛋白。临床试验结果表明,3日龄仔猪肌肉接种疫苗后,可诱导产生特异性IgG和sIgA抗体,且免疫后3个月内IgG抗体仍保持相对较高的水平,同时还能够激活细胞免疫应答;妊娠母猪免疫后,母猪血清和初乳中的特异性IgG和sIgA 抗体滴度显著增加,并能在仔猪血清中检测到IgG与sIgA抗体,为仔猪提供了良好的被动免疫。
核酸疫苗属于第三代疫苗,同时具备亚单位疫苗的安全性和弱毒疫苗的时效性,能够更好地刺激机体的免疫应答。同时,核酸疫苗的研发生产周期相对较短,当病原体发生变异时只需要替换相关的基因序列就能够快速地制备新疫苗。这些特点在新冠 mRNA疫苗的成功应用中得到了体现,随着 mRNA 技术的不断发展和产业链的完善,核酸疫苗有望在未来成为兽用疫苗领域的主力军。
6 展望
传统的灭活疫苗具有安全性好、无毒力返强风险、制品稳定、便于保存运输等优点;弱毒疫苗具有免疫作用快、免疫期长、适用于多种免疫途径等优点,因此被广泛用于临床预防PEDV。随着高致病性PEDV变异株的出现,传统疫苗的效果逐渐受到挑战。因此,提高灭活疫苗的有效抗原含量以及平衡弱毒疫苗的有效性和安全性成为加强传统疫苗免疫保护效力的关键。虽然基因工程技术的发展为新型PEDV疫苗的研发提供了新的思路和平台,但由于安全性、生产成本、免疫保护效果和研发周期等限制因素,基因工程疫苗在实验室走向临床应用还需要时间。在新冠疫情暴发后,mRNA疫苗作为备受关注的疫苗类型,为未来研发PEDV疫苗提供了新的途径和思路。
PEDV是一种肠道感染的病毒。相比于刺激机体产生血清IgG抗体,刺激肠道免疫产生的sIgA抗体更能有效保护仔猪。因此,未来PEDV疫苗的研究重点应放在如何刺激肠道免疫以诱导sIgA抗体的产生以及对sIgA抗体水平的快捷评估。PEDV的蛋白结构与功能挖掘、致病与免疫机制解析有助于为PEDV疫苗和抗病毒药物的研发提供新的靶点,并为通用性冠状病毒疫苗的研发提供新的策略。此外,优化不同类型疫苗的组合使用、创新免疫接种方式和建立现代化疫苗技术平台都有助于提高现有疫苗的免疫效果。随着不断的科学推进和技术发展,我们有望看到更多PEDV疫苗研究技术的突破,从而保障养猪行业的健康持续发展。