
畜牧业是农业和农村经济的支柱产业,各国政府都高度重视动物疫病防控工作,极力支持兽药产业健康发展。而非洲猪瘟(ASF)作为毁灭性的疾病,更是养殖业控制的关键。
ASF疫苗仅在国内就拥有超过10亿头份的市场容量和百亿级别的市场规模。同时,市场也亟待新技术和新产品快速发展突破传统疫苗局限性,如mRNA疫苗,提升动物疫病整体防控水平,控制经济成本。今天,猪好多网与大家一起来梳理非洲猪瘟病毒(ASFV)的结构、产生与传播,并深入比对现有ASF疫苗及其优缺点。
01 疾病和病毒介绍
1.1 ASFV的结构与产生过程
非洲猪瘟(ASF)是由ASFV引起的一种高度传染性猪病,世界动物卫生组织(WOAH)将其列为法定报告动物疫病,该病也是我国重点防范的一类动物疫情。ASF的临床症状分为急性、亚急性和慢性。急性非洲猪瘟起病迅速,持续时间短,其特征是高烧、食欲不振、发绀、严重内出血,死亡率接近 100%。
非洲猪瘟病毒(ASFV)是唯一感染家猪、野猪和钝边蜱的大型双链 DNA 病毒。该病毒具有20面体对称性,直径为200纳米,呈同心圆状,自外向内由外膜、外衣壳、内膜、内衣壳和基因组五部分组成(图1左)。病毒基因组长度在170-190kb,可编码150-200个病毒蛋白,包括68个结构蛋白和100多个非结构蛋白。ASFV形态发生在高尔基体和微管组织中心附近的核周病毒工厂,病毒组装的第一个迹象是从内质网池中形成病毒膜前体,衣壳逐渐组装后,这种病毒膜前体成为多面体中间体。随着衣壳的形成,病毒核心在病毒的内膜下组装,然后细胞内的成熟病毒工厂被转移到细胞表面,并通过从质膜出芽离开宿主细胞(图1右)。
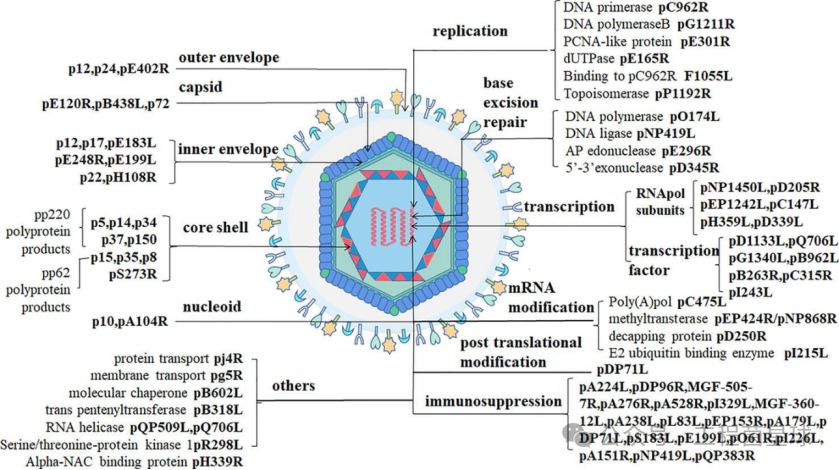
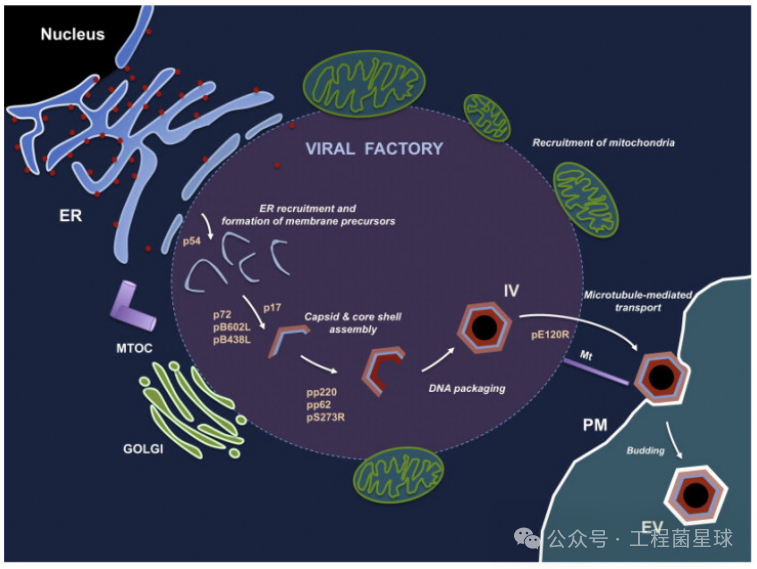
图1 ASFV结构与产生过程(图片来自:参考文献[1])
1.2 ASFV的传播途径
ASF于1920 年首次发现于非洲,随后传播到西欧、拉丁美洲和东欧国家,并于2018年传播到中国。至今,ASF已在我国辽宁、内蒙古、黑龙江等东北地区先后爆发40余起,给我国养猪业造成前所未有的损失。非洲猪瘟病毒涉及多种传播途径,包括直接和间接传播(图2)。
野猪和蜱虫是非洲猪瘟病毒的天然宿主。病猪和死野猪是欧洲病毒的主要来源,先前的研究表明,该病毒可以通过野生-家猪途径传播。在家养中,家猪是病毒的唯一宿主和携带者,但病毒可在猪的分泌物上长久留存,并可使得苍蝇、水蛭和鸟类成为间接病毒携带者。此外,人类活动加剧了病毒传播。ASFV传播的一个重要途径是非法运输受感染的猪肉产品和包括饲料、设备、车辆和衣服在内的污染物。ASFV对温度、pH 值等多种环境条件具有很强的抵抗力,导致病毒可持续存在并完成远距离传播,这可能是病毒在长途运输后传播到新地区的潜在因素。
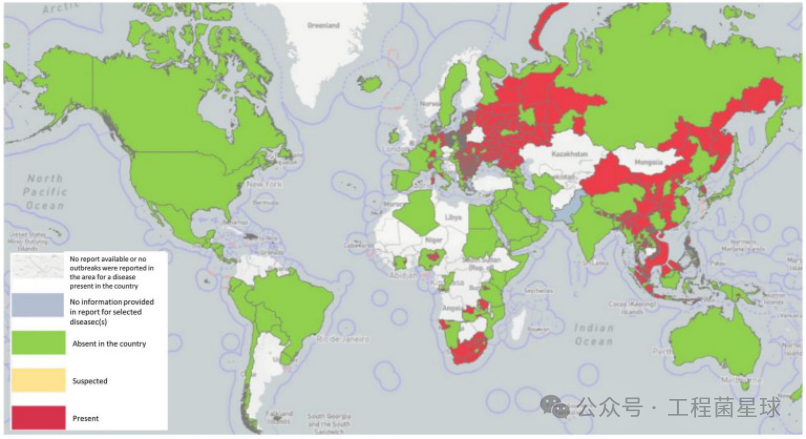
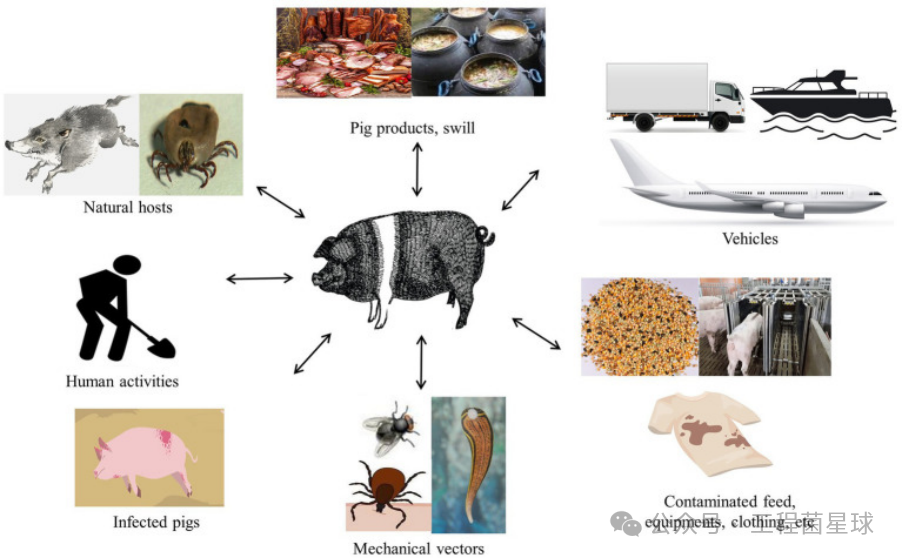
图2 ASF全球蔓延图及ASFV传播途径(图片来自:参考文献[2])
02 ASFV疫苗的研究进展
由于ASFV的存活期较长,传播途径极多。因此,但从检疫和防控来说,成本和性价比极低。疫苗开发是ASF的主流趋势,ASF疫苗在国内有超过10亿头份的市场容量和百亿级别的市场规模。与其他传染性疾病疫苗研发历程相似,ASF在灭活疫苗、减毒疫苗、亚单位疫苗、载体疫苗以及核酸疫苗上均有开发。
2.1灭活疫苗
ASF灭活疫苗的原理是通过加热或加入相应的化学试剂等物理/化学方法,将人工培养的 ASFV杀死,使ASFV丧失原本应有的感染能力和毒性,而只保留免疫原性,灭活后再结合相应的非特异性免疫增强剂(佐剂)制成疫苗。优势是,制备简单快捷、成本低廉,良好的稳定性和较低的存储要求(2-8℃),方便鉴别免疫猪和感染猪,安全性高、无遗传变异风险等。但也存在不足:如只能引起体液免疫,无法引起细胞免疫,免疫应答非常弱或无法持久,需要使用免疫增强佐剂,中和抗体水平差导致灭活疫苗无法对猪产生根本性的保护作用。因此,目前几乎不再考虑研发非瘟灭活疫苗。
2.2 减活疫苗
ASF减毒活疫苗的原理是经过各种处理使ASFV发生变异,令其既降低自身原有的毒性,又保留其免疫原性。分为两种技术路径:一是自然致弱,二是重组致弱/基因工程减毒。减毒活疫苗的优点有能诱导产生强烈且持久的体液免疫和细胞免疫,免疫有效性和保护率好,不需要使用佐剂。但缺点是研发较困难,存储要求较高(-15℃),存在毒力返强、加速病毒重组变异和传播扩散的风险,较难鉴别免疫猪和感染猪。
2022年6-8月,越南与美国共同开发的非瘟减毒活疫苗在临床生产使用时出现较多接种后生猪死亡。因此,非瘟减毒活疫苗的研发仍有比较长的路要走,切勿使用不合规定的非瘟减毒活疫苗。但目前哈尔滨兽医研究所在研的ASFV-7GD备受关注,已在黑龙江、新疆和河南三个养殖基地开展临床试验。
2.3亚单位疫苗
非瘟亚单位疫苗的原理是通过化学分解或有控制性的蛋白质水解等方法,提取ASFV的特殊蛋白质结构,筛选出具有免疫活性的片段,研制成的一种本身不含有ASFV核酸,但却能诱导猪产生免疫保护的疫苗。优点是不含核酸,安全性高,稳定性好,存储要求较低,方便鉴别免疫猪和感染猪。但研发难度高,制备工艺复杂,成本较高,因为选取的是病毒的部分蛋白质片段,免疫原性较低,免疫应答较弱,免疫保护效果较差,需要与佐剂合用才能产生好的免疫效果。
目前,普莱柯与中国农业科学院兰州兽医研究所合作的亚单位疫苗,已向农业农村部提交兽药应急评价材料。
2.4 病毒载体疫苗
病毒载体疫苗通常采用被削弱且本身无法引起疾病的病毒作为载体,以缺陷型腺病毒最为常见,将真正的致病抗原传递到体内,在感染体内细胞后,载体病毒携带的大量抗原可以引发免疫反应,继而产生免疫效果。其优点是免疫效果好,疫苗接种后可以实现抗体的高浓度表达,单剂量足以刺激长期保护。缺点有,载体病毒也可能激发免疫应答、从而降低疫苗的有效性,生产效率较低,成本较高,且存在基因组整合的风险。
基于病毒载体的ASFV疫苗目前主要是华中农大与企业进行合作研发,即将完成转基因生物安全评价,随后提交应急评价申请。
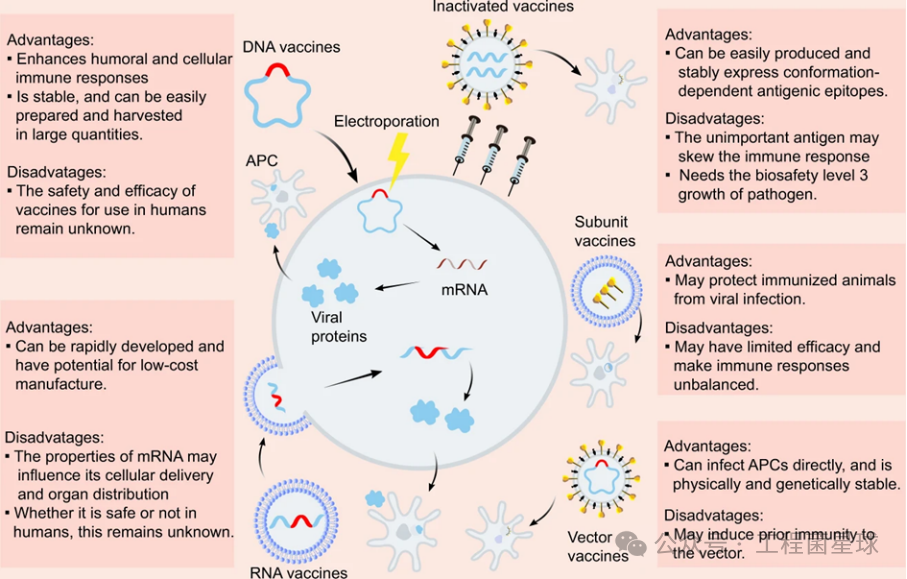
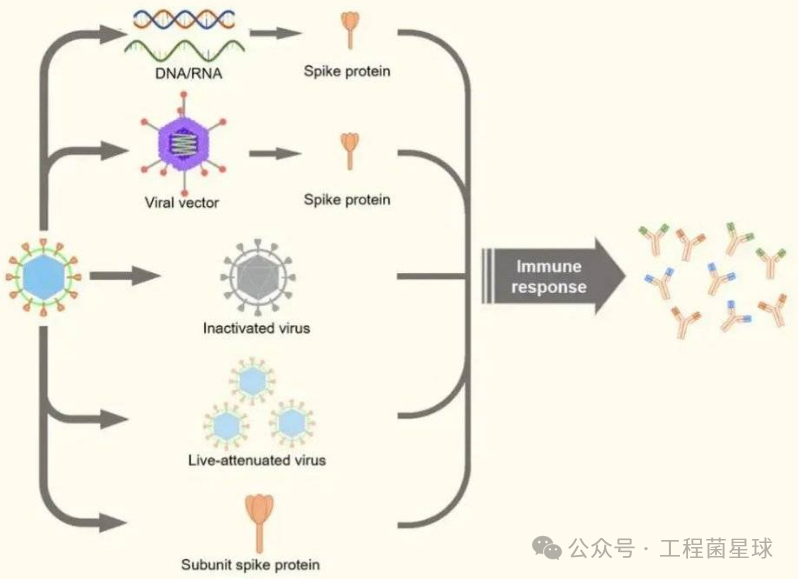
图3 不同类型疫苗的优缺点比较及引发免疫应答方式梳理(图片来自:参考文献[4])
2.5 DNA疫苗
DNA疫苗可经一定途径进入猪体内,被宿主细胞摄取后转录和翻译表达出抗原蛋白,此抗原蛋白能刺激机体产生非特异性和特异性2种免疫应答反应,从而起到免疫保护作用,但也有一定的被整合到宿主基因内的风险,进而危险到人。表1汇总了现有文献报道的ASF DNA疫苗研发情况。
表1 现有ASF DNA疫苗研究情况
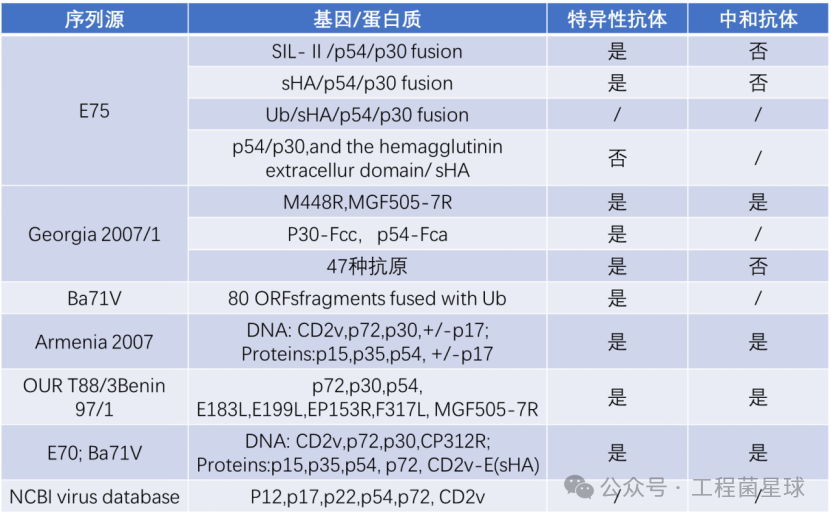
*表格整理自:参考文献[2]
2.6 mRNA疫苗
作为疫苗中的新秀,RNA疫苗由于COVID-19以及2023年度的诺奖,而变得炙手可热,也是开始被引入到兽用疫苗领域。其中,默沙东动物集团针对猪流感疫苗推出的Sequivity IAV-S NA打响了兽用的第一枪。
目前,国内外已有企业陆续公布其关于ASF相关的疫苗研制的计划或进展,美国Genvax公司与农业部合作开发saRNA疫苗;生物股份披露其正在聚焦于非洲猪瘟有效抗原的筛选,作为mRNA疫苗技术储备;金宇保灵去年底与上蓝鹊生物签订《ASF mRNA疫苗合作开发协议》。
mRNA疫苗优势有:
1)良好的耐受性和安全性,不良反应短暂、可控;
2) 无基因组整合风险,无插入突变的风险;
3) 无感染风险,不需借助病毒颗粒;
4) 易降解,减少体内毒性;
5) 同时激活体液免疫和细胞免疫;
6) 生产快速、成本低,不需细胞培养。
03 总结
近年来,随着对ASFV编码蛋白结构和功能研究的不断深入,ASFV的结构和感染过程逐渐清晰。但由于ASFV基因组数量巨大,免疫逃逸机制复杂,病毒致病机理仍不清楚。目前,还没有能够直接消灭ASFV的特效药,所以除了加强动物饲养环境的消毒外,疫苗是阻断病毒传播的重要防治手段。
然而目前,ASFV灭活苗保护效果差,弱毒苗存在毒力返强和扩大病毒传播等安全问题;所以新一代技术驱动下的mRNA疫苗、亚单位疫苗、病毒载体疫苗在 ASF防治过程中具有巨大的应用潜力,陆续已有疫苗处于申请、临床试验阶段。mRNA技术由于其无感染或毒力回复的风险、可同时免疫多种病原体、设计相对容易,研发速度快,生产成本低等优点,逐渐成为ASF开发中的新贵。同时,基于现有ASF DNA疫苗的研究基础,开展进一步的开发,也成为RNA疫苗开发的推动剂,具有较好的市场前景。
最新发布