
以往的研究已经证明,猪瘟流行地区在低效的疫苗接种措施下,猪瘟病毒具有进化为低毒力毒株的趋势。最新研究表明猪瘟病毒先天性持续感染是普遍存在的,持续感染猪瘟的仔猪对后续的疫苗免疫无免疫应答。
期推荐的译文来自OIE西班牙猪瘟参考室首席专家Dr. Llilianne Ganges课题组的又一新作。该研究选择6头猪瘟阴性怀孕母猪,随机分为三组,每组2头,在妊娠74 天分别接种Margarita毒株(1.4基因亚型,高毒力),Cat01毒株(2.3基因亚型,中毒力)、PdR毒株(1.4基因亚型,低毒力),评估不同毒力的猪瘟病毒毒株感染妊娠母猪的能力及其跨胎盘垂直感染胎儿(高毒力或低毒力毒株)和新生仔猪(中等毒力毒株)的结果。
该篇译文发现:
1. 不论感染毒株的毒力如何,所有猪瘟病毒感染母猪后,都有不同程度的跨胎盘感染胎猪的能力。
1.1高毒力毒株感染的母猪出现典型猪瘟症状,肾脏、胃、肠道,膀胱出血。感染母猪出现短暂的毒血症,抗体阳转,扁桃体和肠道组织带毒。其胎猪的扁桃体、肠道、肾脏、淋巴结和脾脏的内出血,全部毒血症,扁桃体,脾脏和胸腺都带毒,病毒载量高。
1.2中毒力毒株感染的母猪未出现任何临床症状。感染后14-21天,检测到中和抗体(1:20),中和抗体持续增加,在感染后28天时均达到1:160。然而,猪瘟病毒的跨胎盘传播没有被阻止,一头感染母猪所生的活仔都发生了持续性的先天性感染。这些小猪增重正常,但都持续毒血症,并通过鼻拭子和直肠拭子高载量排毒,且缺乏猪瘟特异性抗体应答(抗体阴性,病毒阳性)。多头仔猪陆续出现轻度多发性关节炎。
1.3低毒力毒株感染的母猪,临床健康。胎儿在尸检时没有病变。部分仔猪毒血症阳性,扁桃体,脾脏和胸腺的带毒,载量高低不等。
1.4.为了避免经胎盘传播,母猪始终需要保持有一定水平的中和抗体,其中和抗体滴度至少为1/ 320。妊娠母猪用的猪瘟疫苗必须要能产生坚实高效的免疫力,以保证其后代免受猪瘟病毒的感染。
2.胎猪免疫系统能够识别病毒,启动先天性免疫应答,产生一定水平的干扰素,但猪瘟特异性免疫反应都被抑制,出生仔猪都是猪瘟抗体阴性。这是胎猪上首次发现对先天性感染的猪瘟病毒有免疫应答,不是以前理解的免疫耐受(不识别,不应答),而是免疫抑制(能识别,但应答不积极)!!!
3.母抗水平的不理想会促使未感染的仔猪被同窝的先天性持续性感染的仔猪再次感染,并导致慢性或后天性持续性感染的建立,导致猪瘟持续感染的小猪(毒血症,抗体阴性,对疫苗免疫无应答)的比率增加。
译文题目
猪瘟先天性感染胎儿的免疫应答激活和高效病毒复制
Assessment of abortion risk of sows on Japanese commercial farms infected with porcine epidemic diarrhea virus
全文链接:
https://pubmed.ncbi.nlm.nih.gov/32295279/
摘要
猪瘟病毒(CSFV)可引起跨胎盘传播和先天性持续感染。但是,相关研究没有进展。3组母猪在妊娠中期分别感染高、中、低毒力猪瘟病毒株。感染高、低毒力毒株母猪的胎儿在临产前进行了研究,而对感染中等毒力毒株母猪的仔猪进行32 天的追踪研究。低毒力毒株感染母猪后的病毒载量较低,经胎盘传播的比例最低。在感染高毒力毒株的胎儿中,观察到严重的病变和木乃伊化。感染中毒力毒株的母猪出现死产和木乃伊胎,其中1头产活仔猪,均持续感染猪瘟。在感染高毒力和中毒力毒株的母猪中检测到有效的跨胎盘传播。经胎盘传播发生在抗体反应开始之前,抗体反应开始于感染后14 d,并受到感染毒株复制效力的影响。预防先天性持续感染需要母猪接种后产生快速和牢固的免疫。在病毒血症胎儿或组织中有较高病毒复制的胎儿中,CD8+ T细胞亚群和IFN- α反应增加,表明胎儿免疫系统具有识别经胎盘感染的猪瘟病毒的能力。
关键词:经典猪瘟;毒力;跨胎盘传播;持续性先天性感染;胎儿的免疫应答;经典猪瘟病毒;复制;母猪。
1.前言
猪瘟病毒(Classical swine fever virus, CSFV)是猪瘟病毒属中最重要的病毒之一,是猪瘟(Classical swine fever, CSF)的病原体,是世界范围内对养猪业影响极大的疾病。有研究表明猪瘟病毒能跨胎盘传播并产生持续感染的能力。具体来说,当母猪在妊娠50-90 d感染低毒力猪瘟病毒后,其所生仔猪持续感染猪瘟病毒。发生这种感染的仔猪出生时就被感染,在缺乏特异性抗体反应的情况下,病毒复制和排毒都很高。由于胎儿未成熟的免疫系统无法识别猪瘟病毒——免疫耐受机制,导致这种类型的持续性感染的发生。
CSF仍在亚洲、加勒比和中南美洲国家流行。以往的研究已经证明,猪瘟流行地区在低效的疫苗接种措施下,猪瘟病毒具有进化为低毒力毒株的趋势。就此而言,最近的一项研究表明猪瘟病毒先天性持续感染是普遍存在的,这有利于病毒流行,阻碍控制效果。
猪瘟病毒也有产生后天性持续感染的能力,与先天性持续感染不同,由中毒力猪瘟毒株引起。既往研究也表明,中等毒力毒株分布广泛。与此相关,日本事隔26年后再次爆发猪瘟,其毒株已经确定是中度毒力。
尽管猪瘟病毒跨胎盘途径传播和引起持续性先天性感染的能力已为人所知,但很少有科学研究涉及这种疾病的免疫发病机制,特别是从病毒-宿主相互作用的角度。在此背景下,本研究旨在评估不同毒力的猪瘟病毒毒株感染妊娠母猪的能力及其与经胎盘垂直感染胎儿的关系。同时,对毒力大小在猪瘟病毒先天性持续感染的作用也进行了研究。本研究对感染母猪的胎儿和仔猪评估了猪瘟病毒复制水平,也从细胞因子的产生和免疫系统细胞群的变化的角度评估了免疫反应。
2.结果
2.1 母猪感染PdR或Margarita猪瘟毒株的临床评价
在第一个试验中,为了确定不同毒力水平的猪瘟病毒株诱导胎盘传播感染的能力,两组妊娠母猪在妊娠74天时接种猪瘟病毒。A组(1号和2号母猪)用猪瘟高毒力Margarita毒株感染,B组(3号和4号母猪)用低毒力PdR株接种。临床体征由有经验的兽医做每日记录。
接种后,感染Margarita猪瘟毒株的2头母猪(A组)在感染后6 ~ 11 天均出现厌食症。随后,2号母猪开始正常进食,而1号母猪的临床情况逐渐恶化,出现便秘或腹泻,出现高热,体重明显下降,最终出现后躯虚弱。出于动物福利的原因,1号母猪在感染后17天(妊娠91 天)的时候被安乐死,2号母猪在感染后22天(妊娠96 天)的时候被安乐死。两头受Margarita感染的母猪尸检显示相似的病变,包括肾脏、胃和肠道的瘀点,1号母猪的膀胱也有瘀点。相反,接种PdR毒株的3号和4号母猪在整个研究中保持健康,尸检未发现与猪瘟病毒感染相关的病变。
2.2母猪感染PdR或Margarita毒株后猪瘟病毒RNA
水平的检测
采用逆转录-定量PCR(RT-qPCR)检测每周采集的血清和尸检采集的组织样本中的CSFV RNA。根据循环阈值(Ct),RNA载量可分为高、中或低,如材料和方法部分所述。猪血清中检测到的猪瘟病毒RNA载量从中到低不等(Ct值从28到35),与用于感染母猪的毒株的毒力程度无关。A组和B组(分别感染Margarita株或PdR株)的所有母猪均在感染后8天时检测到RNA。然而,在感染后14天开始,一直到实验结束,B组的2头母猪和A组的2号母猪的样品均为阴性(图1A)。值得注意的是,只有感染CSFV Margarita毒株的1号母猪在感染后14天时和安乐死时(感染后17 天)呈阳性,尽管RNA载量低(Ct值34)。
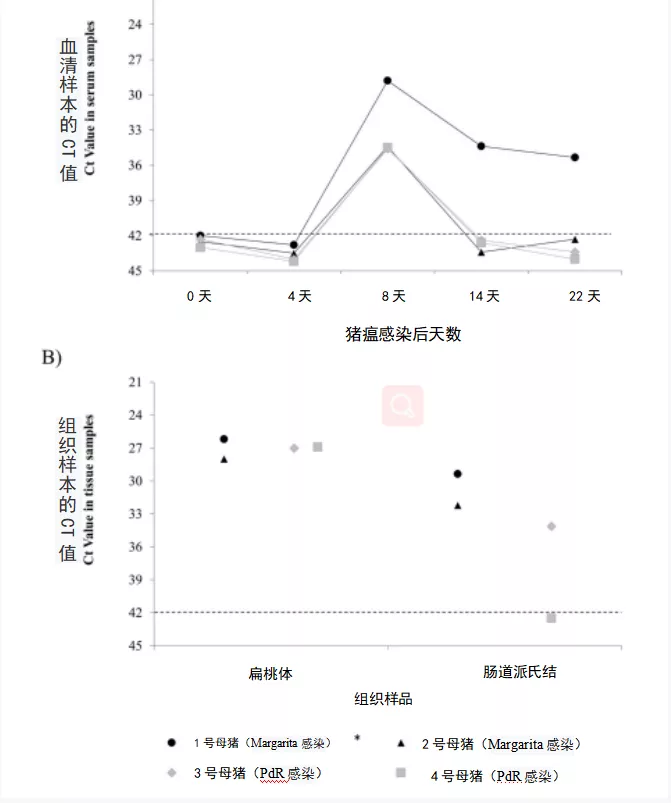
图1 RT-qPCR检测到的母猪样品中的猪瘟病毒(CSFV)RNA载量
(A)感染后不同时间点的母猪血清中检测到的RNA水平。(B)猪瘟Margarita株(黑色符号)和PdR株(灰色符号)感染的母猪组织中检测到的RNA水平。
循环阈值(Ct)大于42(虚线)视为阴性。星号表示在感染17天安乐死的母猪。
在组织样本中,两实验组扁桃体样本中检测到的CSFV RNA载量相似,Ct值在27左右(中等RNA载量)。两组的肠道派氏结样本中病毒RNA载量也相似,除了4号母猪(PdR感染)为阴性(图1B)。
2.3高毒力Margarita猪瘟毒株比PdR株在感染母猪体内
引起的体液反应更快、更高
每周分别用ELISA和中和过氧化物酶联免疫分析(NPLA)检测血清中特异性抗E2抗体和中和抗体。A组猪瘟感染母猪在感染后14天和安乐死时均检测到抗E2抗体。B组PdR毒株感染母猪,只有一头母猪在感染后22天时显示抗E2抗体阳性(图2A)。
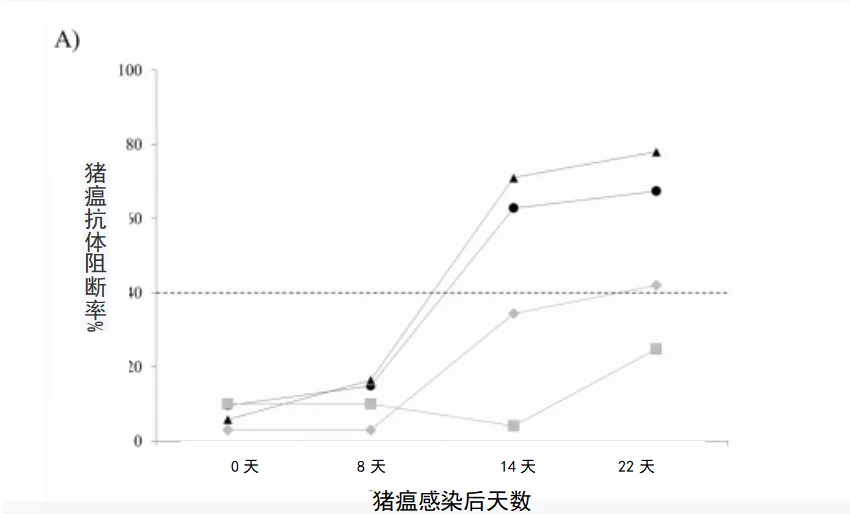
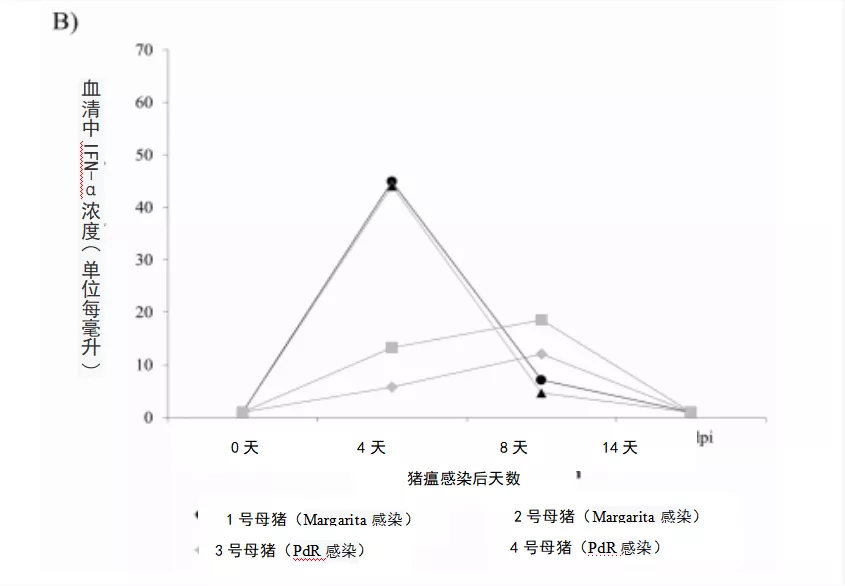
图2 猪瘟感染母猪的免疫反应。
(A) ELISA检测针对猪瘟E2糖蛋白的特异性抗体反应(阻断率%),值在40%以上(虚线)视为阳性。
(B)ELISA检测感染Margarita(黑色符号)或PdR毒株(灰色符号)感染母猪的血清中干扰素α (IFN-α)的反应。血清中IFN-α的浓度以单位/mL表示。星号表示在感染后17天安乐死的母猪。
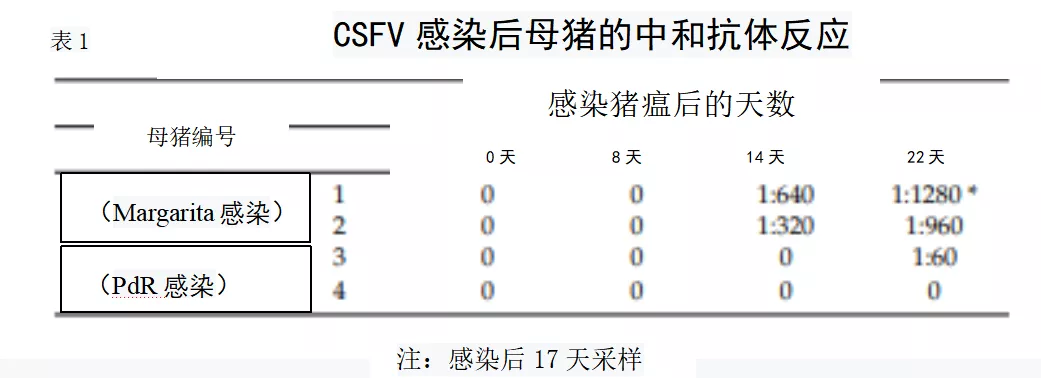
同样,通过NPLA检测发现感染Margarita的2头母猪的中和抗体在感染后14 天开始检测到,1号母猪和2号母猪的中和抗体滴度分别从感染后17和22天升高。在PdR感染的母猪中,只有3号母猪在感染后22天时检测到中和抗体反应,而4号母猪在整个试验中没有显示中和抗体(表1)。
2.4猪瘟高毒力毒株或低毒力毒株感染母猪的IFN-α和
IFN-γ的反应
采用ELISA法检测母猪感染后不同时间点血清中干扰素α(IFN-α)和干扰素γ (IFN-γ)水平。A组和B组母猪血清中在感染后4天和8天均检测到IFN-α。值得注意的是,A组(1号母猪和2号母猪)在感染后4天时的IFN-α水平最高(图2B)。两组母猪感染后血清中均未检测到IFN-γ水平。
2.5猪瘟感染母猪胎儿的尸检评价
猪瘟Margarita毒株感染母猪的胎儿表现出扁桃体、肠道、肾脏、淋巴结和脾脏的内出血。此外,1号母猪的4个胎儿和2号母猪的3个胎儿在皮肤上普遍有出血性病变(数据未显示)。此外,两个母猪体内都出现了木乃伊化的胎儿。相反,接种PdR低毒毒株的3号母猪和4号母猪的胎儿在尸检时没有病变。
2.6垂直传播和胎儿中猪瘟病毒的复制
在预产期前两周,剖腹产后,从所有胎儿体内收集血清和组织样本,以确定猪瘟通过母猪向胎儿的传播。A组所有的胎儿血清,扁桃体,脾脏和胸腺的样本(见表2)经RT-qPCR检测为高CSFV RNA载量(Ct值15.67至23)。在不同的器官,1号和2号感染母猪的胎儿的平均Ct值分别在17.28到20.33之间。相比之下,PdR感染母猪的13个胎儿中只有3个胎儿(23%)RT-qPCR检测血清呈阳性,其RNA载量从高到低不等(表2)。然而,再用RT-qPCR分析扁桃体,脾脏和胸腺的样本时,发现猪瘟病毒阳性的胎儿数量分别增加到11个(3号母猪)和9个(4号母猪)。阳性组织中CSFV RNA载量从高到低不等。
2.7猪瘟感染母猪的胎儿的免疫反应
本研究中所有胎儿血清中均未发现猪瘟特异性体液反应。然而,IFN-γ水平仅在1号母猪(感染Margarita毒株)的13个胎儿中的5个胎儿的血清样本中检测到,值在23.2 - 130.9 pg/ml之间。此外,在感染Margarita的母猪的11个胎儿样本中也检测到IFN-α水平(表3)。有趣的是,感染低毒力毒株(PdR)的母猪的胎儿显示更高水平的IFN-α(100至200单位/ml)。值得注意的是,IFN-α阳性出现在猪瘟病毒RNA阳性的四个胎儿中或在组织样本中猪瘟病毒RNA载量较高的胎儿中(表2和3)。最后,在两个实验组的胎儿血清样本中检测到可溶性CD163 (sCD163)水平,A组样品浓度是B组的10倍(图3)。
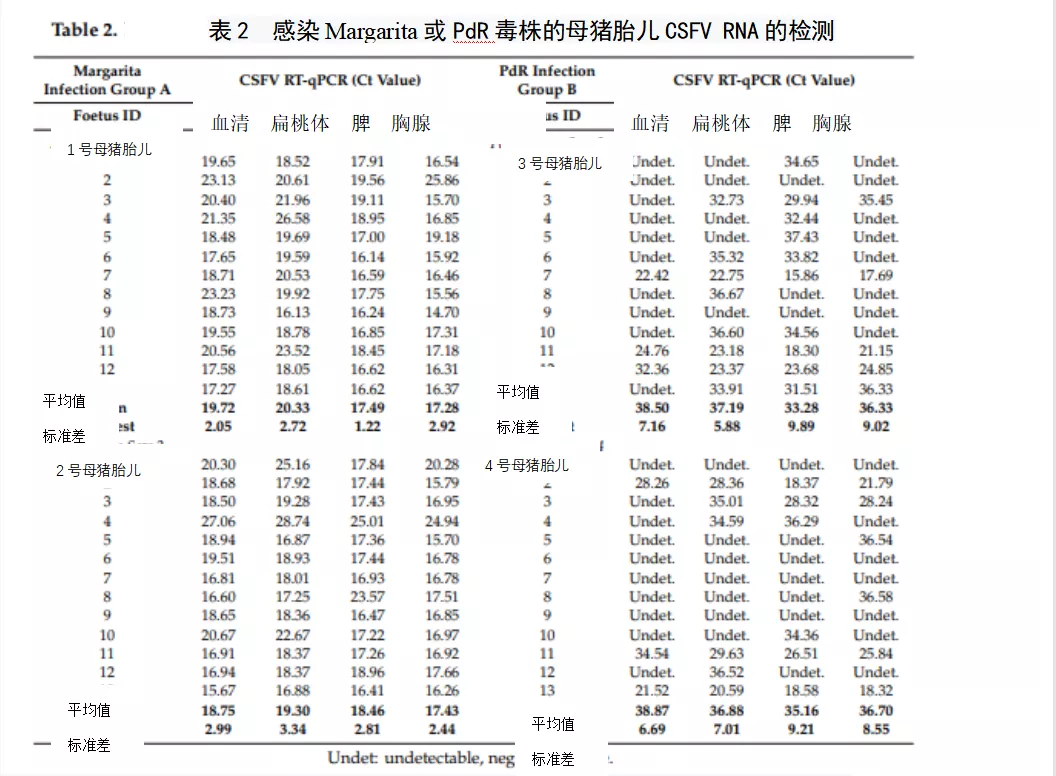
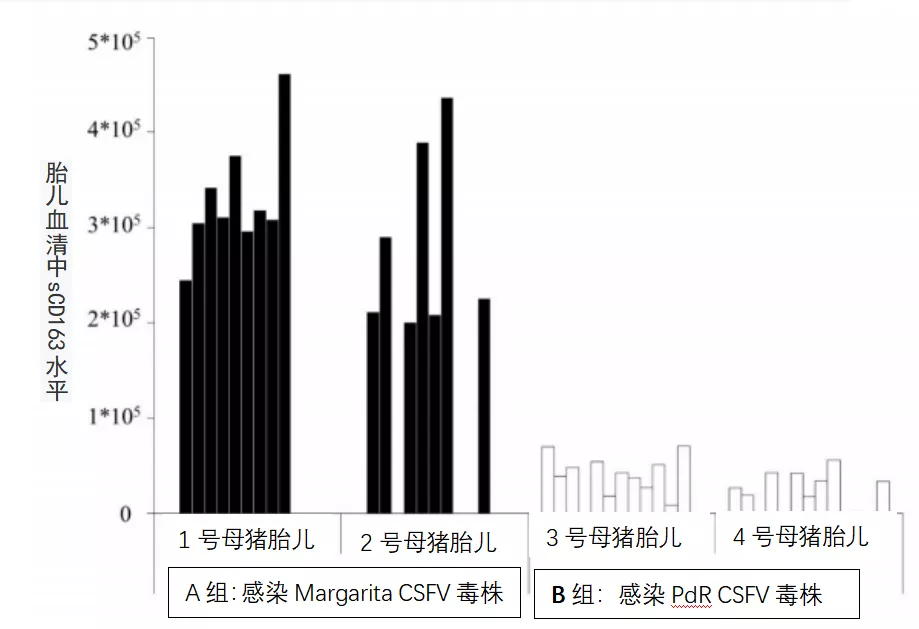
图3胎儿血清sCD163水平。
感染Margarita(黑条)或PdR(白条)CSFV毒株的母猪的胎儿的sCD163水平,以转染CD163细胞的等效拷贝数表示。
2.8 CSFV感染胎儿的外周血单核细胞的表型特征
从每组各抽取3个胎儿的全血,然后分离外周血单核细胞(PBMCs)。流式细胞术分析这些细胞的表型。所分析的PBMC与血清样本中CSFV RNA水平的胎儿相对应。此外,还分析了来自同一猪场的未感染母猪的3个胎儿的PBMC,作为未感染对照的参照。Margarita(A组)感染胎儿的CD4 +T细胞亚群数量从占PBMC的4%增加到16%,3个样本中的2个数值低于5%(图4)。对B组三个胎儿的PBMC测试发现,其CD4 +细胞亚群数量在14%到17%之间,而在未感染对照组的胎儿中的CD4 +T细胞亚群数量差异较大,11%到38%不等。与此相反,猪瘟感染胎儿的CD8 +T细胞亚群数量增加,A组胎儿中其数量在29%到56%之间,B组胎儿(感染PdR毒株)中其数量在20%到27%之间,而在未感染对照组的胎儿中其数量往往低于15%(图4)。
2.9猪瘟中等毒株的感染:母猪的临床症状和病毒的复制
在第二个实验中,为了评估CSFV中等毒力毒株诱导跨胎盘感染和先天性持续性感染的能力,对两头怀孕母猪(5号和6号母猪)接种Catalonia 01毒株(Cat01)。与实验1一样,感染在妊娠74 天进行,并由一名训练有素的兽医每天记录临床体征。感染Cat01的母猪接种后未出现任何临床症状。然而,在感染后34 天(妊娠108天)时,6号母猪早产并生下8只死胎和2只活仔。所有死产的仔猪都表现出出血性病变,而活仔猪非常虚弱,给予安乐死,同时,这头母猪也被实施了安乐死。感染Cat01的母猪血清、直肠拭子和鼻拭子在感染后7天时CSFV RNA均阳性。所有样本CSFV RNA载量均较低,Ct值范围为31 ~ 37。随后,两头母猪都清除了病毒,只有6号母猪的直肠拭子在感染后28天呈阳性,RNA载量低(Ct 35.59)(数据未显示)。
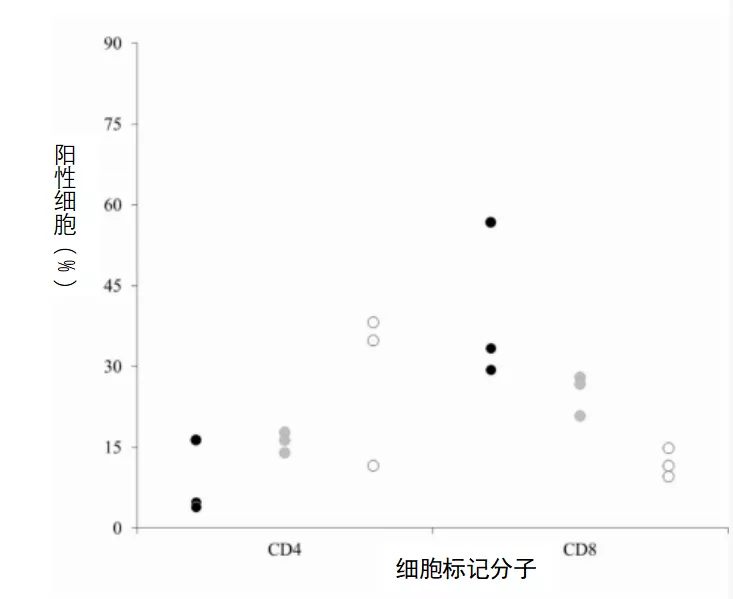
图4比较未感染胎儿(白点)、感染Margarita(黑点)或PdR(灰点)CSFV毒株胎儿的PBMCs中CD4+和CD8+ T细胞亚群的数量。
2.10中毒力猪瘟毒株产生的垂直传播和先天性持续感染
在妊娠114 天时,5号母猪产活仔8头,死产6头,初生的活仔精神好,由母猪正常喂养。在分娩后的7 天内,有2头仔猪被母猪压死在猪圈内,而其余6头仔猪(1至6号仔猪)没有临床症状。在试验的32 天内,1号、3号、5号仔猪保持临床健康。与此同时,其他3头仔猪(2号、4号和6号仔猪)从第10 天开始到研究结束出现了散发性高热(低于41ºC)。6号仔猪从第10天开始出现轻度多发性关节炎,2号和4号仔猪分别在第30天和第23 天出现轻度多发性关节炎。值得注意的是,在实施安乐死时,小猪体重约为8.5 kg,并继续表现出正常的进食行为。
出生当天,仔猪直肠拭子样本RT-qPCR检测呈阳性,CSFV RNA高载量(Ct值约为23)(表4)。尽管没有CSF特异性临床症状,但在试验全程的所有血清样本中检测出高CSFV RNA载量(Ct值约20),表明在试验期间小猪体内存在持续的病毒血症(表4)。同时,在出生后32 天内的鼻拭子和直肠拭子样本中始终存在高病毒载量的排毒。在整个试验中,大多数动物的Ct值都在增加,鼻拭子和直肠拭子的Ct值在22和24左右(表4)。
2.11猪瘟中毒力毒株引发的母猪和仔猪免疫反应
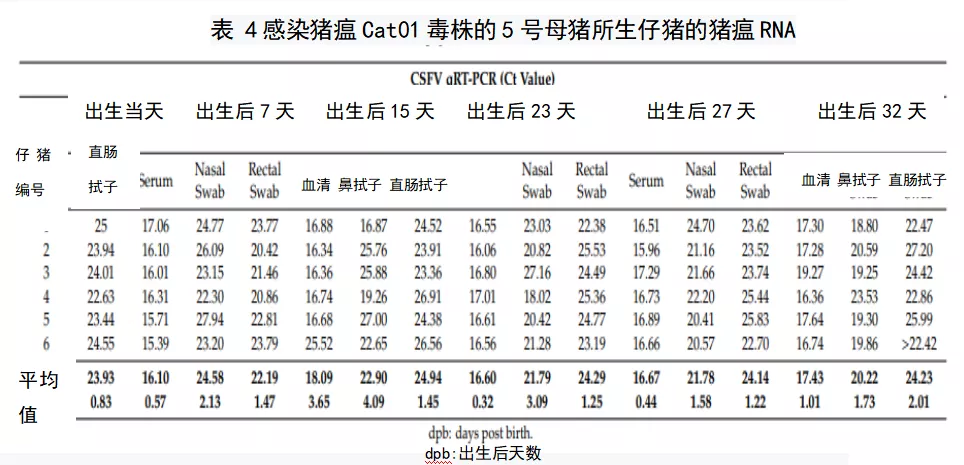
感染后,6号母猪在感染后14天出现猪瘟特异性体液反应,而5号母猪在感染后21天血清转阳,猪瘟抗体阻断率分别为42%和60%,在整个研究过程中,阻断率不断增加。5号母猪在感染后21天(滴度为1:20)检测到中和抗体,6号母猪在感染后14天检测到中和抗体(滴度为1:20),并且两头母猪的中和抗体持续增加,在感染后28天时均达到1:160。尽管如此,仔猪出生后32 d内均未出现ELISA或NPLA抗体阳性反应。有趣的是,4头仔猪在出生后8天和15天的血清中检测到IFN-α(图5A)。另一方面,对持续感染仔猪的PBMC分析中发现了感染cat01的仔猪的CD4+和CD8+ t细胞亚群发生了变化。虽然CD4+T细胞亚群在未感染、年龄匹配的仔猪中没有超过5%,但在持续感染的动物中,这些细胞的数量从4%到16%不等。另一方面,感染仔猪的CD8+T细胞亚群增加(约50%),而未感染仔猪的CD8+T细胞亚群在9.6-23.5%之间(图5B)。
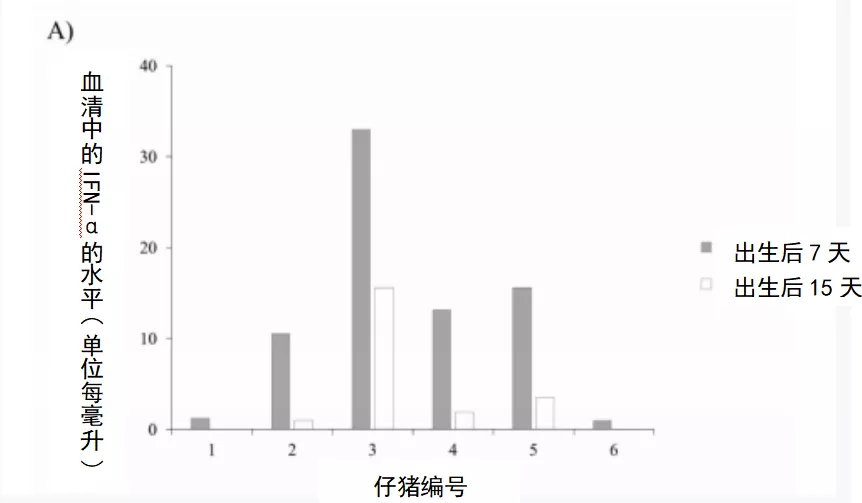
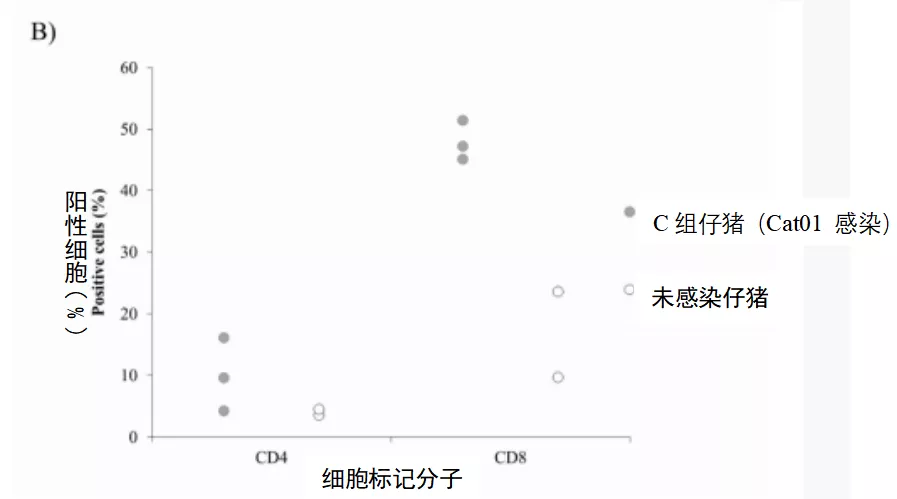
图5.CSFV先天性持续感染仔猪的外周血单核细胞的IFN-α水平及表型特征(A)猪瘟持续感染仔猪血清中IFN-α的浓度,出生后7天(灰条)和出生后15天(白条),浓度用单位/mL表达。(B)未感染仔猪(白点)和感染Cat01的仔猪(灰点)的外周血单核细胞中T-CD4+和T-CD8+细胞亚群的数量比较。
3.讨论
猪瘟先天性持续性感染早在几十年前就有报道。然而,关于这种形式的疾病的发生机制仍有待阐明。在本次试验中,三组母猪分别感染了 Margarita、Cat01或PdR 猪瘟毒株,这些毒株之前分别被鉴定为高、中、低毒力。本研究选择感染怀孕74天的母猪,根据先前的研究,这个时间点可以产生持续性先天性感染。在其他因素完全一致的条件下,本研究比较高毒力和低毒力毒株的跨胎盘感染能力和诱导胎儿免疫反应的能力(图1和2,表1和2)。与以前仔猪试验上的结果一致,高毒力Margarita猪瘟毒株诱导母猪血清中出现了高水平但持续期较短的IFN-α。相反,低毒力PdR毒株诱导的IFN-α反应较低,但持续时间较高毒力毒株长一周。这说明了高毒力猪瘟毒株感染宿主后复制效率很高,使其获得对先天免疫反应的加剧能力,这可能解释了这两组母猪发病机制的差异,与PdR毒株感染母猪表现出来的临床上保持健康和病毒复制水平较低相比,感染Margarita的母猪的病变更严重,且病毒持续存在。高毒力的Margarita毒株更容易通过胎盘传播,在这组胎儿的血清和组织中检测到高载量的病毒RNA。相反,一小部分PdR感染母猪的胎儿器官中具有较高的病毒复制,而大多数胎儿要么未感染,要么组织中仅显示低载量的病毒RNA。尽管Margarita感染母猪产生了免疫反应,但Margarita病毒跨过母体胎盘传播给了胎猪(表1和2,图2)。与之前的数据类似的是, 感染高毒力猪瘟毒株的母猪体内病毒的复制率高可能解释说明这些母猪中和抗体反应的激活。然而,考虑到抗体反应是在感染两周后出现,很可能是在母猪感染后第一周中发生了跨胎盘传播。联系前面描述的数据,为了避免经胎盘传播,在感染时就应该有一定水平的中和抗体,其滴度至少为1/ 320。
在Margarita猪瘟毒株感染的胎儿中发现了木乃伊化和出血性病变。这些胎猪很可能在出生前就死了。相反,在PdR猪瘟毒株感染的胎儿中既没有发现木乃伊,也没有观察到肉眼可见的损伤,即使在那些表现出病毒血症和器官中高水平的病毒复制的胎儿中也是如此。众所周知,母猪通过初乳将猪瘟被动免疫传递给仔猪。这些母源抗体(MDA)可有效保护出生后前几周的仔猪,抵抗包括猪瘟在内的疾病。由此可以推测母猪感染低毒力PdR株后产生的免疫力较低,会导致传递给仔猪的母源抗体(MDA)不足以对仔猪提供全面的保护。这种情况可能会产生严重的后果,因为母抗水平的不理想会促使未感染的仔猪被同窝的先天性持续性感染的仔猪再次感染,并导致慢性或出生后持续性感染。最近,据报道,在一个猪瘟呈地方性流行的猪群中,母源免疫力的缺乏导致持猪瘟续感染的小猪的比率很高。值得注意的是,持续感染猪瘟的仔猪已被证明对疫苗免疫无反应。这种复杂的情况可能导致恶性循环,严重干扰猪瘟持续感染地区的防控工作。
在用中毒力猪瘟毒株Cat01进行感染的情况下,其中一头感染的母猪出现了早产,两头母猪都出现了木乃伊胎和死胎。有趣的是,感染Cat01的母猪均产生了猪瘟中和抗体反应。然而,病毒的跨胎盘传播没有被阻止,一头Cat01感染母猪所生的活仔都发生了持续性的先天性感染。这些小猪增重正常,但都被感染并高载量排毒,且缺乏猪瘟特异性抗体应答。有趣的是,这些仔猪体内的病毒复制水平与感染高毒力毒株的母猪胎儿的病毒复制水平相当,甚至更高(表2和4)。这一发现表明,中度毒力猪瘟毒株在与宿主相互作用中具有免疫调节能力。之前的数据显示,这种类型的猪瘟毒株也能产生持续的后天性感染。与出生后持续感染相似,在先天性病毒持续期间发现低水平的IFN-α,尽管有高的病毒复制,说明处于免疫抑制状态。类似的机制可能发生在先天性或后天性病毒持续感染的建立过程中。
最近,外周血髓系来源的抑制细胞群已被确定在仔猪出生后猪瘟持续性感染的建立中发挥相关作用。鉴于这些细胞亚群是在脐带中发现的,而且在人胎儿阶段发现,因此不能否认它们在CSFV先天性持续性感染的建立过程中发挥了作用。另一方面,有报道称,低CD4/CD8比值是免疫反应失调的标志。在出生后持续感染CSFV的动物中,CD8+ T细胞数量增加,导致CD4/CD8比值降低。在本研究中,每个实验组的感染胎儿和仔猪的PBMC中观察到CD8+ T细胞亚群的增加。这一发现可能表明,免疫抑制机制也发生在经胎盘感染猪瘟的动物身上。
血清中IFN-α和IFN-γ的出现是先天免疫系统激活的标志,在胎儿和仔猪中都发现IFN-α的表达,不论感染毒株的毒力和猪免疫系统的成熟程度(表3和图5)。I型干扰素应答通过发挥抗病毒和免疫调节作用,激活病毒感染后的先天免疫。猪瘟病毒能够在猪体内诱导高水平的IFN-α应答,这与受感染动物的疾病严重程度和病毒复制有关。IFN-α反应在病毒血症胎儿或低毒力PdR毒株感染组的高病毒复制的器官中最高。值得注意的是,PdR毒株对仔猪高且长时间激活IFN-α的能力与在猪瘟基因组的30个非翻译区发现的36-尿苷连续序列有关。在分别感染牛病毒性腹泻和寨卡病毒后,反刍动物和人类胎儿对IFN-α反应的激活已经被证实,这可能支持本研究获得的结果。因此,先前发现的与CSF先天持续性感染形成相关的免疫耐受机制,是一种复杂的免疫现象,进一步的研究可以解释这一机制及其与病毒持续性感染建立的关系。
以往的报道表明,在急性感染非洲猪瘟病毒(ASFV)等高致病性病毒时,sCD163的水平会由于组织损伤而升高。此外,也发现IFN-γ水平升高是ASFV发病机制中细胞因子风暴现象的一部分。与在感染高毒力猪瘟 Margarita病毒的胎儿中发现的出血性病变和病毒复制水平一致,IFN-γ和sCD163的增加可能与病毒感染后宿主免疫反应加剧有关,导致细胞稳态失衡和组织损伤。
综上所述,我们的结果表明,猪瘟毒株的病毒复制能力影响其跨胎盘传播的效力和持续感染的建立。同样,中等毒力的猪瘟毒株在经胎盘感染仔猪后产生猪瘟先天性持续性感染的效率非常高。我们的结果也表明,跨胎盘感染发生得非常快,往往在母猪产生中和抗体之前就发生了。因此,妊娠母猪用的猪瘟疫苗必须要能产生快速而高效的免疫力,以保证其后代免受猪瘟病毒的感染。
另一方面,猪瘟病毒经胎盘感染胎猪后,胎猪免疫系统能够识别病毒并产生免疫应答。需要进一步的研究来阐明在最初识别病原体后,针对猪瘟的特异性免疫反应被削弱的机制。据我们所知,这是第一个报告显示胎儿感染CSFV后出现了免疫反应。
4.材料和方法
4.1细胞和病毒
用病毒悬液在2%的无病毒胎牛血清中感染敏感细胞,在添加5%胎牛血清在培养基中培养猪肾细胞系PK-15 (ATCC CCL 33,Middlesex,England)。感染后,细胞在37°C、5% CO2下孵育,72 h后收获病毒。过氧化物酶连接试验(PLA)用于病毒滴定,按照Reed和Muench描述的统计方法。CSFV PdR和Margarita株均属于1.4亚基因型,分别为低毒力毒株和高毒力毒株。Cat01株属于亚基因型2.3,被选为中毒力原型毒株。
4.2试验设计
来自商品猪场的6头妊娠68 天的母猪(长白猪)被安置在西班牙巴塞罗那CReSA生物安全3级(BSL3)动物房中。这些动物是从没有瘟病毒疾病的农场购买的,在抵达CreSA动物房前,它们也接受了猪瘟抗体的检查。动物编号从1到6,分为3组(从A到C),每组在一个单独的具有标准设施的栏位中。采用之前建立的方法来评估CSFV的跨胎盘传播能力,每个试验组包括2头母猪。经过5 天的驯化期(妊娠74 天),1号和2号母猪(A组)接种猪瘟Margarita株,3号和4号母猪(B组)接种PdR株,5号和6号母猪 (C组)接种Cat01株。所有接种的病毒剂量为每只动物10的5次方 TCID50,接种方式为颈部肌肉注射。感染后,一名受过训练的兽医每天记录临床症状。试验进行两个试验,试验1包括A组和B组,试验2包括C组母猪。
实验1分别在感染当天和感染后4、8、14、22 天采集血清和鼻拭子、直肠拭子样本,分别对应妊娠第74、78、82、88、96 天。此时,按照所遵守的欧洲指令2010/63/EU的指导,对母猪实施了安乐死。在感染当天和安乐死前获得EDTA全血,用于体外收集PBMCs。尸检后,从扁桃体和派氏结收集组织样本。同时,按照之前描述的步骤,尽量减少对胎儿的应激,从所有母猪中获得胎儿。所有的胎儿都进行了详细的尸检,对不同器官进行了肉眼病变的评估。每头母猪采集13个胎儿的血清、全血样本和组织(扁桃体、脾脏和胸腺)。
在实验2中,分别在感染当天和怀孕第81、87、95和102 天(感染后7、14、21和28天)采集血清样本。分娩时采集所有仔猪直肠拭子。母猪和仔猪一起饲养21天,离开母猪后,仔猪饲喂适宜阶段的饲粮(StartRite、Cargill、西班牙),直至试验结束。仔猪的处理是按照先前描述的程序进行的。
在仔猪出生后7、15、23、27和32天时采集血清和鼻腔和直肠拭子。此时,根据欧洲指令,收集全血样本并对仔猪实施安乐死,通过颈静脉给予过量的戊巴比妥,60-100 mg/kg体重。此外,根据先前的研究,如果母猪和仔猪出现与猪瘟相似的临床症状或表现出虚弱行为,在试验结束前对它们实施安乐死。根据西班牙和欧洲现有的法规,该实验得到了巴塞罗那自治大学(UAB)动物实验伦理委员会的批准。
4.3 CSFV RNA检测
采用NucleoSpin RNA分离试剂盒(Macherey-Nagel,Düren,Germany),按照制造商提供的方案,从血清、鼻腔和直肠拭子样本以及器官样本中提取RNA。所有试验中,从150 µL的初始样品体积中,最终提取出50 µL的RNA。病毒RNA的检测是通过之前描述的RT-qPCR检测进行的,在我们实验室验证了血清、鼻腔、直肠拭子和组织样本中CSFV RNA的检测。当Ct值等于或小于42时,视为阳性。此外,利用Ct值,确定样本具有高(Ct值低于23)、中(23 - 28之间)或低(Ct值高于28)CSFV RNA载量,如前所述。未检测到荧光(Undet)的样品被认为是阴性的。
4.4 E2特异性和中和抗体的测定
在母猪、胎儿和仔猪的血清中使用商业ELISA试剂盒评估CSFV E2特异性抗体(IDEXX实验室,利布菲尔德,瑞士)。当阻断率≥40%时,根据制造商的建议,视为阳性结果。此外,针对各自感染毒株的中和抗体使用NPLA测定;因此,A组、B组和C组的动物被评估为针对 Margarita、PdR和Cat01株的中和抗体。中和抗体滴度表示为能中和50%的100个TCID50病毒的血清最大稀释度的倒数。
4.5血清IFN-α ELISA检测
在A组和B组的胎儿和母猪以及C组的出生后7天和15天仔猪的血清中,使用之前描述的自己建立的ELISA测试来测定IFN-α的浓度。简单地说,用抗IFN -α单克隆抗体(K9克隆,PBL生物医学实验室,Piscataway, New Jersey, USA)涂在平板上过夜。洗涤后,将50 µl的血清样品和一系列稀释的IFN-α重组蛋白(PBL生物医学实验室)重复镀,37℃孵育1 h。随后,洗涤培养皿,加入生物素化的抗IFN -α抗体(F17克隆,PBL生物医学实验室)。在37℃条件下孵化1 h,然后冲洗板,并加入链霉亲和素HRP。最后,在30 min的孵育后,使用3,30,5,50-四甲基联苯胺(TMB),以H2SO4 1N作为停止溶液,揭示了这项技术。在450 nm下读取平板,使用细胞因子标准的光密度建立回归线来确定细胞因子浓度(单位/ml)。
4.6 ELISA检测IFN-γ和sCD163
在A组和B组胎儿及母猪的血清中分析IFN-γ和sCD163,商用ELISA检测IFN-γ(IFN-γ ELISA Kit, Porcine,Life Technologies),按照制造商说明,结果以微克/毫升(pg/ml)表示。最后,使用之前描述的ELISA方法,使用转染CD163的CHO细胞裂解液作为标准,定量sCD163。结果以转染等量的CD163 CHO细胞(ENC)的表达。
4.7 PBMC采集和流式细胞术检测
在试验1和试验2中,从每组3只动物尸检时采集的全血中获得PBMC,之前的特征是通过RT-qPCR。细胞通过hisstopaque 1077 (Sigma-Aldrich St. Louis,MO,USA)密度梯度离心分离,然后通过渗透休克来清除剩余的红细胞。用台盼蓝染色测定PBMCs的数量和活力。此外,分别在妊娠期间和产后进行血液样本采集,其中胸腺细胞采集选择3个未感染的胚胎(试验1),而血液样本选择3个未感染胚胎(试验1)和仔猪(试验2)进行操作。
采用流式细胞术检测胎儿和仔猪PBNC的表型特征。使用单抗对猪CD4 (74-12-4,IgG2b)Alexa Fluor 647结合物(BD Biosciences)和CD8-α(76-2-11,IgG2a)fitc标记物(BD Biosciences,Franklin Lakes,美国新泽西)。
染色方案如前所述。染色后,细胞被过滤并通过细胞仪(FACSAria IIu,BD Biosciences),每个样本记录10,000个细胞事件。使用FACSDiva软件(版本6.1.2)对细胞进行分析,结果以每次染色获得的阳性细胞百分比表示,使用无关的同型匹配单克隆抗体作为染色对照。
最新发布