
导读
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)引起的一种急性、传染性肠道疾病,给全球养猪业造成了巨大的经济损失。PEDV主要感染新生仔猪,具有流行广、传播快、致死率高等特点。由于新生仔猪免疫系统不成熟,通过直接免疫新生仔猪不能及时产生保护力,只有主动免疫母猪产生的免疫力经乳汁转移给新生仔猪,通过被动免疫才能保护新生仔猪。因此,很多大型猪场采用小肠组织返饲母猪(饲喂感染 PEDV 仔猪的小肠组织或从粪便中分离的 PEDV 活毒)的方式诱导母猪产生主动免疫,再通过哺乳使新生仔猪获得被动免疫,从而达到控制PED的目的。尽管这种方法使PED在猪场中暂时得到控制,但随后会使母猪成为带毒的感染源从而给猪场造成巨大的隐患(母猪带毒)。
该译文实验室近年来对部分猪场的调查结果证实,尽管返饲母猪对控制PED的发生起到一定作用,但返饲后PED依然不断发生。经过调查发现PEDV存在于母猪乳汁的细胞中,因此提出了PEDV能够经母猪乳汁垂直传播给新生仔猪的假设。
为验证这一假设,该译文对多个返饲猪场母猪和其新生仔猪进行 PEDV调查,同时对新生仔猪灌服PEDV阳性乳汁中的细胞试验,结果表明返饲母猪所哺乳的仔猪和灌服的新生仔猪均出现典型的PED腹泻症状,并且小肠上皮中含有大量病毒。
因此本研究将围绕这一现象对PEDV在母猪体内从肠道传播到乳腺并进一步进入乳汁中,以及PEDV从乳汁传播给新生仔猪的机制进行深入研究。试验结果表明母猪返饲含有PEDV的小肠组织后,在母猪肠上皮细胞复制的病毒传递给位于肠上皮细胞间的CD3+T淋巴细胞。随后携带PEDV的CD3+T 淋巴细胞经血液循环从肠道迁移到乳腺。最后,携带 PEDV的CD3+T淋巴细胞随着母乳进入新生仔猪肠道,通过直接接触的方式将病毒传递给肠上皮细胞,引起新生仔猪的肠道感染。
本篇译文揭示
对多个猪场返饲(感染PEDV的小肠组织)的母猪初乳进行调查,发现44.5%的乳汁样本中存在PEDV,其中病毒主要存在于乳汁中的CD3+T淋巴细胞中,母乳中的CD3+T 淋巴细胞可能介导了PEDV的垂直传播。
母猪返饲感染PEDV的小肠组织后,感染PEDV的肠上皮细胞将病毒传递给位于肠上皮细胞间的T淋巴细胞,然后携带病毒的CD3+T淋巴细胞通过血液从肠道迁移到乳腺并进入腺泡腔(初乳)。
携带病毒的CD3+T淋巴细胞主要通过直接接触的方式将病毒传递给肠上皮细胞, 这一过程主要依赖于细胞间黏附分子‐1(Intercellular adhesion molecule 1,ICAM‐1)。并且返饲母猪乳汁中的细胞因子TGF‐β通过上调新生仔猪肠上皮细胞ICAM‐1的表达,从而促进携带病毒的CD3+T淋巴细胞以直接接触的方式将病毒传递给肠上皮细胞。
首次阐明了PEDV在母猪体内进行传播进入乳汁和通过乳汁传播给新生仔猪的机制。不仅为预防新生仔猪感染PEDV提供了新的策略,还为人类传染病的垂直传播的研究提供了一个动物模型。
猪流行性腹泻病毒经母猪初乳垂直传播给新生仔猪机制的研究
A Novel Pathway for Porcine Epidemic Diarrhea Virus Transmission from Sows to Neonatal Piglets Mediated by Colostrum
全文链接:
https://pubmed.ncbi.nlm.nih.gov/35758666/
摘要
初乳介导的病毒传播机制很难阐明,因为缺乏实验动物模型,从临产母猪采集组织样本也绝非易事。猪流行性腹泻病毒(PEDV)作为一种肠道致病性冠状病毒再次流行,对全球养猪业造成了灾难性影响。PEDV主要通过多种途径感染新生仔猪,尤其是1-2日龄新生仔猪。我们的流行病学调查和动物攻毒实验表明,PEDV可以通过初乳从母猪垂直传播到新生仔猪,初乳中的CD3+T细胞在这一过程中发挥重要作用。结果表明,PEDV经口感染母猪后定植在肠上皮细胞(IECs),然后可以转移到位于肠上皮细胞下方的CD3+T细胞。接下来,携带PEDV的CD3+T细表达整合素α4β7和CCR10,通过血液循环从肠道迁移到乳腺。携带PEDV的CD3+T细胞到达乳腺后,可穿过乳腺上皮细胞(MECs)进入乳腺内腔(初乳),如自体回输试验和MECs/T共培养系统所示。
初乳中携带PEDV的CD3+T细胞可散布在新生仔猪的肠上皮细胞之间,通过细胞间接触引起肠道感染。我们的研究首次证明,来自初乳的CD3+T细胞是PEDV垂直传播的潜在途径。
重要性
初乳是许多病毒的重要感染途径。在这里,我们证明了猪流行性腹泻病毒(PEDV)通过初乳从母猪到新生仔猪的垂直传播。定植于肠上皮细胞的PEDV可将转移到母猪肠内的CD3+T细胞。母猪肠道中携带PEDV的CD3+T细胞表达整合素α4β7和CCR10,通过血液循环到达乳腺,并通过乳腺上皮细胞进入内腔,最终通过新生仔猪的细胞间接触导致肠道感染。我们的研究不仅证明了PEDV感染的另一种途径,而且还提供了人类传染病垂直传播的动物模型。
关键词
初乳、T细胞、新生仔猪、PEDV、乳腺上皮细胞
猪流行性腹泻病毒(PEDV)导致新生仔猪出生后急性腹泻、脱水和高达100%的死亡率。目前,还没有安全有效的预防新生仔猪感染PEDV发病的疫苗,这使得PEDV的预防和控制具有挑战性。由于PEDV的高毒力和新生仔猪的免疫系统不成熟,因此对PEDV的被动乳源免疫力对新生仔猪的保护至关重要。在母猪感染肠道病毒时,肠源性免疫球蛋白A(IgA)分泌细胞迁移到乳腺(乳腺s),并在初乳中产生高滴度的分泌性IgA(sIgA)抗体(通过肠-乳腺-sIgA轴),产生被动乳源免疫力。
临床上为了控制PEDV,包括“返饲”或受控的全群暴露感染,整个母猪群用猪场的病料(从被感染仔猪上采集的粪便和肠道组织)饲喂来刺激肠道-乳腺轴产生对PEDV的主动免疫。母猪对PEDV产生的免疫力可以通过初乳/常乳转移到新生仔猪。该策略的结果令人满意,因为临床疾病的发生率显著下降;然而,返饲并非100%有效。生产中有些母猪实际上是用活病毒免疫过,而所产的仔猪仍然感染了PEDV并有临床症状。然而,PEDV导致新生仔猪感染的背后机理尚未得到证实。
采取寄养能够降低新生仔猪感染PEDV后的死亡率,许多研究人员据此提出了初乳传播PEDV的可能性。据报道,PEDV不仅可以在初乳中检测到,还可以从猪场上返饲感染的母猪的初乳样本中分离出来。然而,初乳中PEDV的来源仍不清楚。
对以上现象,我们提出了母猪初乳可能是PEDV从母猪传播到哺乳仔猪的一种新的感染途径的假设。经验证的动物模型和收集的临床证据均证实,新生仔猪可通过初乳感染PEDV。使用乳腺上皮细胞(MECs)和T淋巴细胞以及T淋巴细胞和Vero细胞建立体外共培养模型,以进一步了解PEDV通过感染母猪的初乳进入新生仔猪肠上皮细胞的机制。据我们所知,我们的研究首次证实初乳源的CD3+T细胞是PEDV从母猪垂直传播至新生仔猪的潜在途径。
结果
临床上感染PEDV的母猪将PEDV传给哺乳仔猪。
最近,我们的流行病学调查显示,母猪和哺乳期新生仔猪在母猪用猪场的PEDV感染病料返饲后表现出不同程度的腹泻和食欲不振;然而,如果停止新生仔猪哺乳,腹泻程度显著降低。这一现象激发了我们对新生仔猪腹泻原因的研究兴趣。
首先,在发生腹泻的猪场,我们通过检测来确定返饲感染的母猪及其新生仔猪中是否存在PEDV。免疫组织化学(IHC)染色和免疫荧光分析(IFA)结果表明,在返饲感染母猪的小肠和乳腺中观察到许多PEDV阳性(PEDV+)细胞(图1a至1c)。Western blot分析结果进一步验证了不同组织中的PEDV水平,并且在返饲感染母猪的空肠和乳腺中检测到大量PEDV N蛋白(图1d)。接下来,通过多种方法测定了PEDV在新生仔猪小肠中的分布。如下文所述,PEDV也可在返饲感染母猪哺乳的新生仔猪的十二指肠、空肠和回肠中检测到(图1e至1g)。这些结果表明,临床上新生仔猪可能通过初乳感染PEDV。
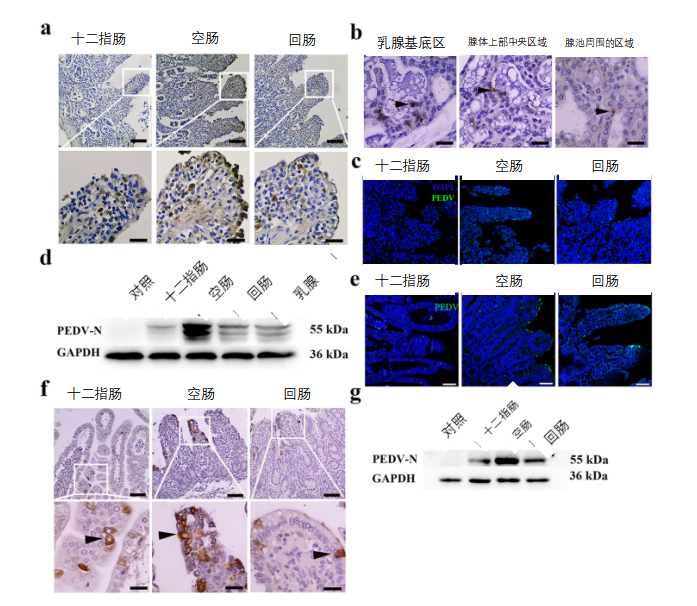
图1 PEDV在母猪和新生仔猪中的分布。
所有母猪,总共1000头,包括妊娠母猪,返饲一次所需的病料,但产房中的哺乳母猪除外(包括分娩前21天内的妊娠母猪)。本研究中的母猪在妊娠约60天时返饲PEDV病料,并在分娩后72小时进行安乐死,并收集相关组织进行检测。(a)返饲感染母猪在哺乳期时肠道的免疫组织化学检测(IHC)。PEDV抗原位于肠绒毛内。标尺=100 μm(顶部)和20 μm(底部)。(b)返饲感染母猪乳腺的免疫组织化学检测(IHC)。PEDV抗原位于乳腺中。标尺=20 μm.
(c)返饲感染母猪肠道的免疫荧光分析(IFA)。PEDV抗原位于肠绒毛内。标尺=50 μm.蓝色,DAPI;绿色,PEDV。(d) 通过使用针对N蛋白的小鼠酶标抗体(mAb)的Western blot方法测定返饲感染在哺乳期母猪的不同组织中PEDV的蛋白表达。(e)腹泻初生仔猪肠道的免疫荧光分析(IFA)。PEDV抗原位于肠绒毛内。标尺=50 μm.蓝色,DAPI;绿色,PEDV。(f)腹泻初生仔猪肠道的免疫组织化学检测(IHC)。标尺=100 μm(顶部)和20 μm(底部)。(g) 用抗N蛋白的小鼠单克隆抗体通过Western blot方法测定腹泻新生仔猪肠道中PEDV的蛋白表达。标尺=50 μm.蓝色,DAPI;绿色,PEDV。
初乳中携带病毒的T细胞导致新生仔猪感染PEDV。
为了研究新生仔猪如何通过初乳感染PEDV,我们进行了一项实验调查,从四个农场诊断为腹泻的母猪中收集了总共200份样本(初乳)。通过PCR可以在44.5%(89/200)的母猪初乳样品中检测到PEDV的N基因(数据未显示)。Western blot分析显示母乳细胞中有显著的大量的PEDV N蛋白,但在乳汁上清液中未检测到PEDV N蛋白(图2a)。我们怀疑初乳中的某些类型细胞可能携带PEDV。我们实验室早前的研究表明,CD3+T细胞可携带PEDV,导致仔猪的感染(3)。因此,我们采用各种方法鉴定初乳中的CD3+T细胞。如预期的那样,CD3+T细胞不仅分布在乳腺(乳腺s)中,而且还可以跨乳腺上皮细胞(MEC)运输到内腔(初乳)(图2b至e)。
令我们惊讶的是,荧光活化细胞分选(FACS)分析显示,返饲感染母猪初乳中4.63%的CD3+T细胞为PEDV阳性(图2f)。此外,我们使用共聚焦显微镜观察PEDV和CD3+T细胞的亚细胞位置。免疫荧光分析(IFA)显示PEDV N蛋白与CD3+T细胞共聚焦,并且PEDV确实被CD3+T细胞内化(图2g)。
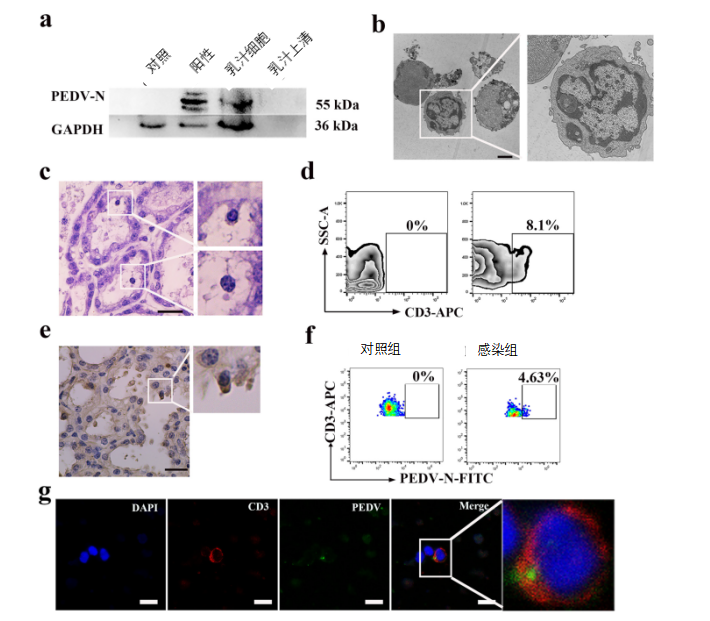
图2 在返饲感染母猪的初乳中鉴定出携带PEDV的CD3+T细胞。
结果来自一头典型症状的母猪。用不同方法检测了12份PEDV阳性乳汁样品。(a)返饲感染的母猪初乳中PEDV的蛋白表达通过使用针对N蛋白的小鼠单克隆抗体的Western blot测定。(b)通过透射电镜(TEM)鉴定初乳中的淋巴细胞。标尺=2μm。(c)返饲感染母猪乳腺组织的苏木精和伊红(H&E)染色。放大的细胞是淋巴细胞。标尺=20μm。(d)通过流式细胞仪(FACS)分析携带来自猪初乳的PEDV的CD3+T细胞。SSC,侧面散射。(e)免疫组织化学检测(IHC)显示乳腺中的CD3+T细胞。放大图像表示CD3+T细胞。标尺=20μm。(f和g)流式细胞仪(FACS)分析(f)和免疫荧光分析(IFA)(g)检测从哺乳期返饲感染的母猪收集的初乳的CD3+T细胞中的PEDV。标尺=10μm。蓝色,DAPI;绿色,PEDV;红色,CD3。FITC,异硫氰酸荧光素。
为了评估初乳细胞中携带的PEDV颗粒的致病性,进行了动物实验。首先,结果表明,在口服来自返饲感染母猪的初乳源细胞后,大量病毒分布在新生仔猪的小肠中(数据未显示)。随后,为了确定初乳中CD3+T细胞携带的PEDV是否足以引起新生仔猪感染,我们还进行了动物感染实验。通过磁珠分离(磁激活细胞分选[MACS])法分离来自返饲感染母猪的初乳源性的CD3+T细胞,并直接给予新生仔猪。当然,获得的初乳源性的CD3+T细胞是有活性的。对照组的仔猪饲喂等量的磷酸盐缓冲盐水(PBS)。口服初乳CD3+T细胞的新生仔猪在感染后8小时(hpi)开始出现呕吐白色泡沫,持续约1天。在感染30小时后,新生仔猪开始出现腹泻,粪便呈灰黄色和水样。感染60小时后,出现不同程度的腹泻,大便呈黄色,气味难闻,呈水样。通过实时定量PCR(RT-qPCR)在不同时间对口服来自返饲感染母猪的初乳衍生的CD3+T细胞的新生仔猪粪便中的PEDV的排毒进行定量。
结果表明,PEDV基因拷贝在感染48小时内达到9.95log10拷贝的峰值,然后逐渐减少(图3a)。最后,将CD3+T细胞接种仔猪和阴性对照仔猪安乐死,在感染60小时进行病理学检查。与对照组中的新生仔猪相比,感染仔猪的肠绒毛高度显著降低,绒毛上皮细胞出血和脱落(图3b)。RT-PCR、免疫组织化学检测(IHC)和Western blot结果显示,口服来自初乳的CD3+T细胞后,仔猪的十二指肠、空肠和回肠中存在PEDV(图3c至e)。因此,我们的结果证实,来自返饲感染母猪的初乳源性的T细胞可能导致新生仔猪的PEDV感染。
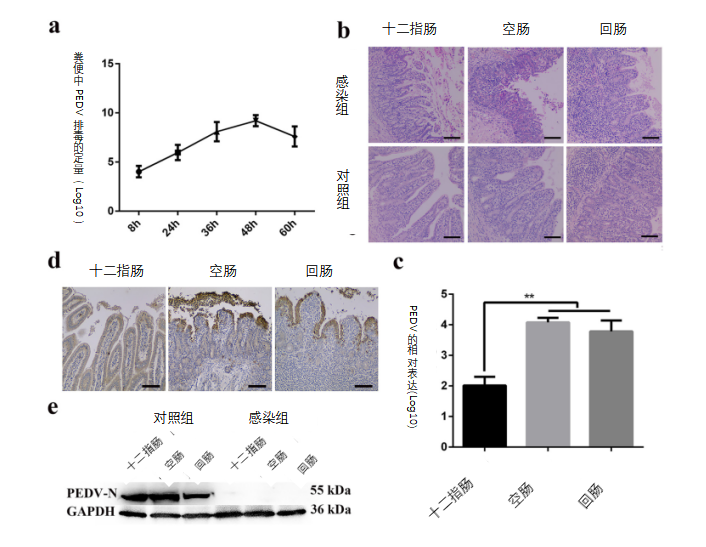
图3 初乳中携带病毒的CD3+T细胞引起新生仔猪的PEDV感染。
(a)通过RT-qPCR测定粪便中排出的PEDV RNA的滴度。(b)在光镜下观察对照组和感染组新生仔猪的绒毛形态。(c)经口接种携带PEDV的CD3+T细胞后腹泻仔猪小肠中的病毒RNA表达(每组3头仔猪)。(d)经口接种携带PEDV的CD3+T细胞后仔猪肠道的免疫组织化学检测(IHC)。PEDV抗原位于肠绒毛中。标尺=20 μm。(e)腹泻仔猪小肠中的PEDV蛋白表达通过使用针对N蛋白的小鼠单克隆抗体的Western blot测定。至少进行了三个独立的实验。所有数据均表示平均值±SD。通过方差分析(ANOVA)(多组)进行比较,*,P<0.05;**,P<0.01。数据来自至少三个独立实验。
T细胞从肠上皮细胞获得PEDV,并通过母猪的血液循环迁移到乳腺。
PEDV感染主要局限于母猪的肠上皮细胞(IECs);然而,我们的结果显示初乳中有携带PEDV的T细胞。此外,来自肠道的免疫细胞可以利用肠乳轴通过血液循环迁移到乳腺。实际上,如图4a所示,在返饲感染母猪的外周血单核细胞(PBMCs)中检测到1%的CD3+T细胞携带PEDV。与对照组相比,感染组的CD3+T细胞表现出若干形态变化,例如细胞伸长和观察到细胞质中颗粒大小在95至190nm的细胞质PEDV样颗粒的累积(图4b)。此外,免疫荧光分析(IFA)显示,体内感染试验时,返饲感染母猪的肠和乳腺组织中的CD3+T细胞中也存在PEDV(图4c和d)。
为了进一步测定体外感染PEDV的母猪血液来源的CD3+T细胞中的病毒滴度,将来自母猪血液的CD3+T细胞接种PEDV,并用流式细胞仪(FACS)在感染1、6、12和24 小时后收集CD3+T细胞。结果表明,接种PEDV的CD3+T细胞在感染1 小时后达到最大值30.6%。在体外PEDV阳性CD3+T细胞的百分比在感染6-24 小时期间从19.8%逐渐降低到10.3%(图4e)。这些结果表明,CD3+T细胞可能从肠上皮细胞(IECs)获得病毒,进入PBMC循环,并迁移到乳腺。
为了探索位于肠上皮细胞(IECs)下方的CD3+T细胞如何从肠上皮细胞(IECs)获得PEDV,我们接下来以两种不同的方式共培养上皮细胞(Vero)和T细胞,即在接触和非接触条件下,研究体外从Vero细胞到T细胞的PEDV传播途径(图4f)。在共培养中感染后1小时和6小时收集T细胞。与非接触组中的T细胞相比,与Vero细胞接触组中的那些细胞表现出较高的PEDV RNA表达水平和病毒滴度(图4g和h)。Western blot结果进一步证实,装载在Vero细胞上的PEDV可以主要通过直接接触转移到T细胞(图4i)。我们的结果表明,在返饲感染的母猪中,PEDV可以转移到肠上皮细胞(IECs)下方的T细胞,携带PEDV的T细胞可以通过血液循环迁移到乳腺。
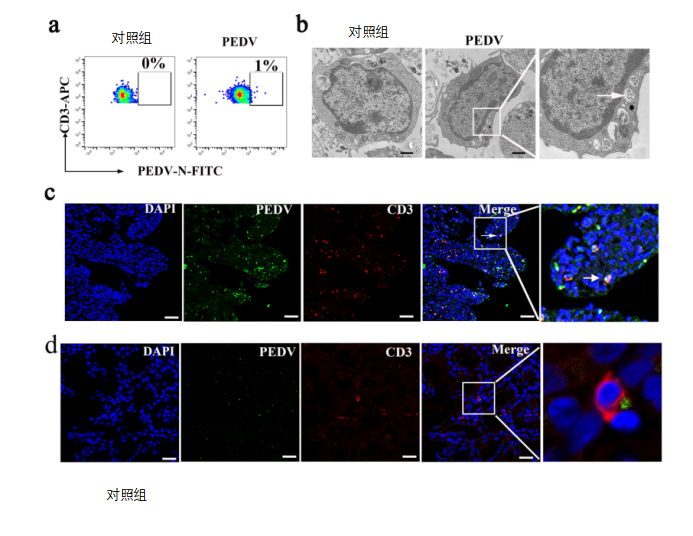
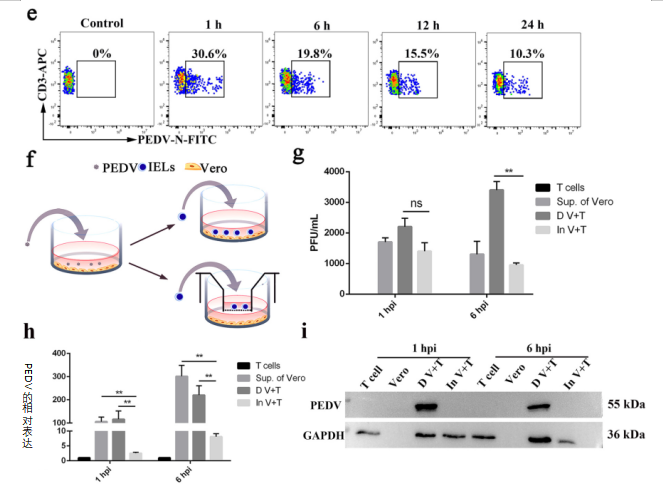
图4 在母猪体内CD3+T细胞从肠上皮细胞(IECs)获得PEDV,并迁移到乳腺组织(乳腺s)。
(a)返饲感染母猪外周血单核细胞(PBMCs)中PEDV+CD3+T细胞的流式细胞仪(FACS)分析。(b)TEM图像显示了感染PEDV的母猪外周血单核细胞(PBMCs)中CD3+T细胞的形态特征和PEDV。标尺=1μm。(c和d)用不同抗原对哺乳期感染PEDV的母猪的空肠(c)和乳房(d)的冷冻切片进行染色,并通过荧光显微镜进行观察。PEDV+CD3+T细胞位于肠绒毛和乳腺中。标尺 =50μm。蓝色,DAPI;绿色,PEDV;红色,CD3。(e)血源性CD3+T细胞在不同时间感染PEDV。通过流式细胞仪(FACS)测定血源性CD3+T细胞中的病毒载量。(f)研究携带PEDV的Vero细胞将病毒传播到T细胞的模型示意图。T细胞通过接触和非接触方式与Vero细胞共培养。接触共培养是携带病毒的Vero细胞与细胞板上的T细胞的共培养方式。非接触式共培养是将T细胞置于转运孔的上隔室,与携带病毒的Vero细胞间接共培养。在共培养感染1小时和6 小时后收集T细胞。在共培养早期可检测到T细胞中的PEDV。
(g)共培养系统的T细胞中的病毒滴度通过噬斑测定(n=3)测量。“D V+T”代表T细胞和Vero细胞之间的直接接触。“In V+T”代表T细胞和Vero细胞之间的间接接触。(h)在共培养系统的T细胞中在1小时和6小时的病毒RNA表达(n=3)。(i)共培养系统的T细胞中PEDV的蛋白表达通过使用针对N蛋白的小鼠单克隆抗体的Western blot检测。所有数据均表示平均值±SD。通过方差分析(ANOVA)(多组)进行比较,*,P<0.05;**,P<0.01;ns,不显著。数据来自至少三个独立实验。
携带PEDV的T细胞迁移并穿过乳腺上皮细胞进入母猪的内腔(初乳)。
T细胞上的整合素α4β7与黏膜地址素细胞粘附分子1(MAdCAM-1)相互作用,在猪的T细胞从肠道迁移到乳腺中起重要作用(4)。我们估计了T细胞表面整合素α4β7的表达水平。事实上,流式细胞仪(FACS)分析表明在不同时间点PEDV感染的T细胞中整合素α4β7表达水平较高(图5a)。此外,与对照组相比,在返饲感染的母猪中,初乳中的黏膜地址素细胞粘附分子1(MAdCAM-1)水平上调(图5b)。使用涂有基质凝胶涂层的聚碳酸酯膜评估黏膜地址素细胞粘附分子1对T细胞迁移的影响(图5c)。在PEDV感染组中,趋化因子黏膜地址素细胞粘附分子1(MAdCAM-1)在感染24 小时下以500ng/mL增加CD3+T细胞迁移(图5d),从而证实T细胞迁移主要由表面整合素α4β7和黏膜地址素细胞粘附分子1(MAdCAM-1)之间的相互作用介导。
为了证实PEDV可以改变表面肌动蛋白丝结构,我们在存在或不存在PEDV的情况下进行了荧光四甲基异硫氰酸罗丹明(TRITC)-鬼笔环肽标记的F-肌动蛋白染色。与对照组相比,在15和30分钟时,在感染的CD3+T细胞中观察到细胞骨架变化,即细胞边缘的F-肌动蛋白聚集(图5e)。此外,PEDV感染后,受感染CD3+T细胞中整合素α4β7和磷酸化粘着斑激酶(粘着斑激酶)和辅酶蛋白的水平显著增加(图5f)。
先前的一项研究表明,整合素α4β7可以激活丝切蛋白和粘着斑激酶信号,这表明PEDV可能通过整合素α4β7激活丝切蛋白和粘着斑激酶的信号。因此,我们研究了整合素α4β7抑制剂CT7758对响应PEDV感染的丝切蛋白和粘着斑激酶信号的影响。正如预期的那样,PEDV诱导的丝切蛋白和粘着斑激酶的激活被CT7758依赖性的整合素α4β7抑制减弱(图5g)。为了进一步研究PEDV感染是否通过粘着斑激酶信号激活丝切蛋白信号,我们检测了抑制剂Y15对粘着斑激酶的影响。结果表明,抑制剂Y15降低磷酸化粘着斑激酶的水平,类似地,PEDV诱导的丝切蛋白活化以Y15剂量依赖性方式减弱(图5h)。因此,我们的结果表明,PEDV利用整合素α4β7-粘着斑激酶-丝切蛋白途径在CD3+T细胞中引起肌动蛋白细胞骨架重排。
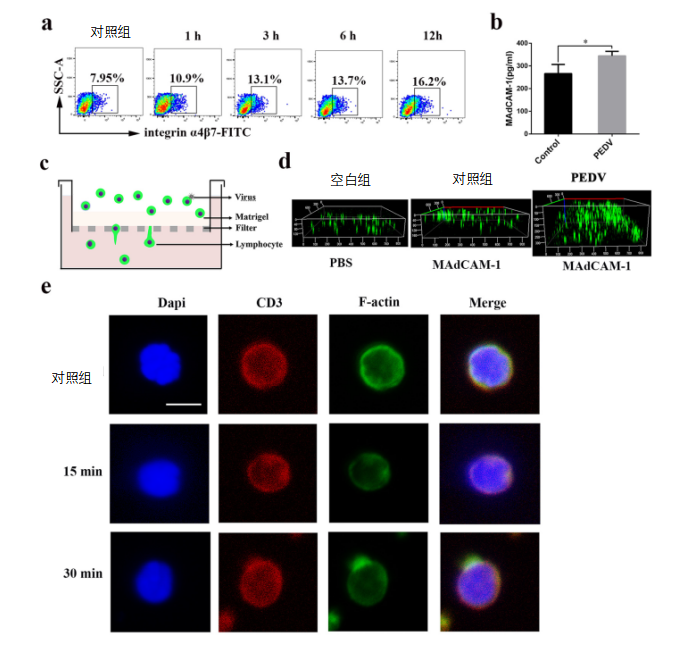
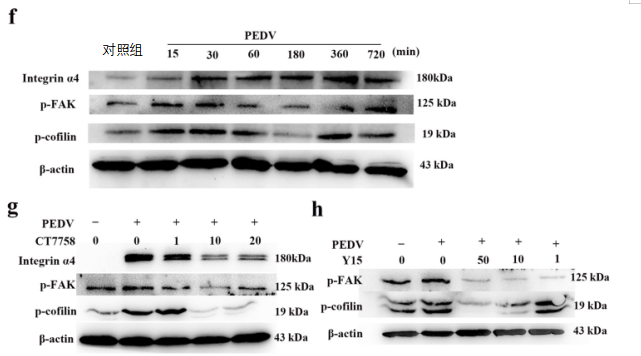
图5 整合素α4β7参与CD3+T细胞将携带PDEV从肠到乳腺的迁移。
(a)在不同时间用PEDV感染T细胞。通过流式细胞仪(FACS)分析T细胞上表型标记整合素α4β7的表达(每组n=3)。(b)通过ELISA测定母猪初乳中MAdCAM-1的水平(对照组和感染组)。(c)转运孔迁移分析的示意图。(d)24孔转运孔板的8um孔径聚碳酸酯过滤器的下侧涂有100ul 50%的基质。在下室中存在或不存在通过原核表达过表达的趋化因子MAdCAM-1的情况下,将CD3+T细胞或感染PEDV的CD3+T细胞(106个细胞每毫升)添加到上室中。在感染12小时后,使用蔡司LSM710共聚焦显微镜拍摄迁移的CD3+T细胞的图像。
(e)PEDV感染后CD3+T细胞的F-肌动蛋白重组。CD3+T细胞用PEDV(MOI=1)感染0、15或30分钟,然后固定、渗透并用CD3抗体、TRITC-鬼笔环肽和DAPI染色。然后用共聚焦激光扫描显微镜记录图像。(f)PEDV感染后整合素α4、粘着斑激酶磷酸化和丝切蛋白磷酸化的时间过程。用PEDV以MOI为1时感染T细胞,并在所指示的时间点,制备细胞裂解物用于蛋白质印迹。(g和h)用整合素α4抑制剂CT7758(g)或粘着斑激酶抑制剂Y15(h)以指示浓度预处理T细胞1小时,然后在各自抑制剂存在下用PEDV(MOI=1)感染0.5小时。制备细胞裂解物并进行Western blotting。
转移到乳腺的T细胞必须穿过乳腺上皮细胞(MECs)进入管腔。如图6a所示,PEDV感染的CD3+T细胞在不同时间点都检测到高水平的CCR10。此外,与对照不同,CCL28蛋白水平在返饲感染母猪的乳汁中被上调(图6b)。因此,我们推测携带PEDV的T细胞通过乳腺上皮细胞(MECs)进入管腔取决于表面趋化因子CCR10和CCL28之间的相互作用。乳腺上皮细胞(MECs)与T细胞共培养系统用于研究T细胞的迁移(图6c)。
与对照组未感染初乳相比,接种含有活PEDV的初乳增加了羧荧光素琥珀酰亚胺氨基酯(CFSE)标记的T细胞的数量(图6d)。值得注意的是,不论T细胞共培养,还是PEDV感染均未改变乳腺上皮细胞的紧密连接的形态特征(数据未显示)。此外,免疫荧光分析(IFA)证实携带PEDV的CD3+T细胞穿过乳腺上皮细胞进入乳腺管腔(图6e)。我们的结果表明,携带PEDV的T细胞通过乳腺上皮细胞进入内腔(初乳)的迁移和通过主要由T细胞上的表面整合素α4β7和CCR10之间的相互作用以及乳腺上皮细胞(MECs)上的MAdCAM-1和CCL28之间的相互作用。
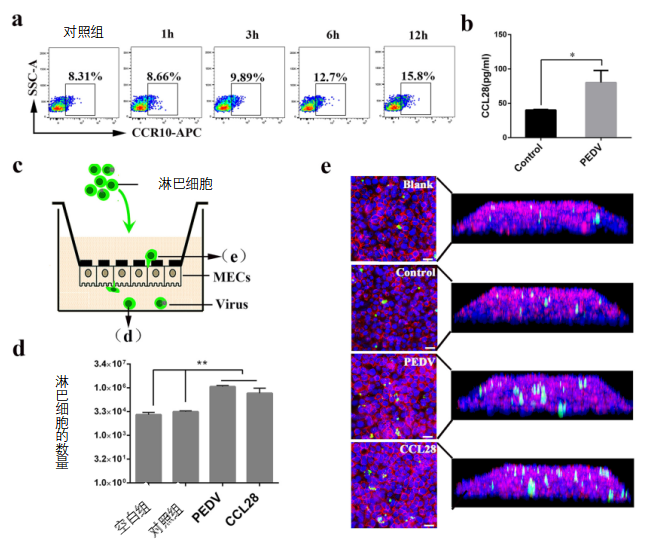
图6 CCR10参与携带PEDV 的CD3+T细胞穿过乳腺上皮细胞进入内腔(初乳)的转运。
(a)在不同时间用PEDV感染T细胞。通过流式细胞仪(FACS)分析T细胞上表型标记物CCR10的表达(每组n=3)。(b)通过ELISA测定母猪初乳中CCL28的水平(对照组和感染组)。(c)转运孔迁移分析的示意图。在下室中存在或不存在趋化因子或初乳的情况下,将感染PEDV或对照的荧光标记淋巴细胞(106个细胞/mL)加入上室。(d) 对从下腔取回的细胞进行计数能够确定完全迁移通过乳腺上皮细胞的淋巴细胞的数量。(e)迁移研究后细胞覆盖滤过器的染色方案,以确定滤过器/上皮系统内淋巴细胞的定位,并接近转移路线。标尺 =20μm。空白,分别在上室和下室中的荧光标记的淋巴细胞和空白培养基;对照,分别在上腔和下腔中从健康母猪获得的感染PEDV和初乳的荧光标记淋巴细胞;PEDV,分别在上腔和下腔中感染PEDV和从感染母猪获得的初乳的荧光标记淋巴细胞;CCL28,分别在上室和下室中感染PEDV和趋化因子CCL28的荧光标记淋巴细胞。
初乳中携带PEDV的T细胞可将病毒转移到新生仔猪的肠上皮细胞。
为了探讨初乳中携带PEDV的CD3+T细胞引起新生仔猪PEDV感染的机制,从返饲感染母猪的初乳中分离CD3+T细胞,用PKH26标记,并直接给新生仔猪服用。免疫荧光分析(IFA)结果显示初乳中的T细胞可以散布在新生仔猪的肠上皮细胞(IECs)之间。因此,细胞间接触结构为初乳的T细胞和新生仔猪的肠上皮细胞(IECs)之间的病毒传播提供了机会(图7a)。为了进一步研究新生仔猪的CD3+T细胞和肠上皮细胞之间是否发生病毒传播,分别从母猪血液和新生仔猪肠道中分离出CD3+T细胞和肠内皮细胞。
建立了接触和非接触两种形式的T细胞与肠上皮细胞(IECs)共培养系统。流式细胞仪分析(FACS)结果显示,接触组在3h时检测到高达13.5%的PEDV+细胞角蛋白-18阳性(CK18+)的肠上皮细胞(IECs),这远远高于非接触组。这些结果表明携带PEDV的T细胞允许病毒主要通过直接接触转移到肠上皮细胞(IECs)。当用ICAM-1抑制剂A205804处理肠上皮细胞(IECs)时,在共培养系统中许多含PEDV的肠上皮细胞(IECs)显著减少(图7b)。这些数据表明,ICAM-1在CD3+T细胞和肠上皮细胞之间的PEDV传播中起积极作用。
初乳中的母源细胞因子和抗体可影响新生仔猪肠上皮细胞(IECs)的功能。因此,我们通过酶联免疫吸附试验(ELISA)研究了健康母猪和发病母猪初乳中白细胞介素-6(IL-6)和肿瘤坏死因子α(TNF-α)(炎症反应)、干扰素γ(IFN-γ)和IL-12(Th1)、IL-10和IL-4(Th2)、转化生长因子β1(TGF-β1)(Th3)、IgA和IgG的浓度。感染期间初乳中的PEDV特异性IgA水平显著降低,但血清中的IgG抗体无显著差异。令人惊讶的是,与对照组的水平相比,返饲感染的母猪中的细胞因子TGF-β的水平显著升高,除了IL-12和IL-4它们没有显著差异之外,其他细胞因子呈现相反的结果(图7c和数据未显示)。
与对照样品相比,用5或10ng/mL TGF-β处理2小时的肠上皮细胞(IECs)增加了ICAM-1的表达(图7d)。为了确定TGF-β是否可以通过上调肠上皮细胞(IECs)上ICAM-1的表达来促进CD3+T细胞和肠上皮细胞(IECs)之间的病毒传播,我们建立了CD3+T细胞和肠上皮细胞(IECs)之间的共培养系统。基于流式细胞仪(FACS)分析的体外评估显示,浓度为5ng/mL的TGF-β可显著增加肠上皮细胞(IECs)中的病毒产量。然而,ICAM-1抑制剂A205804抑制了CD3+T细胞和肠上皮细胞(IECs)之间的病毒传播(图7e)。
此外,使用MACS分离柱分离来自共培养模型的肠上皮细胞(IECs),并用RT-PCR来检测肠上皮细胞(IECs)中的病毒基因(图7f)。肠上皮细胞(IECs)中病毒基因的发现证实了流式细胞仪(FACS)结果(图7g)。这些结果表明,TGF-β通过上调肠上皮细胞(IECs)中ICAM-1的表达促进CD3+T细胞和肠上皮细胞(IECs)之间的病毒传播。
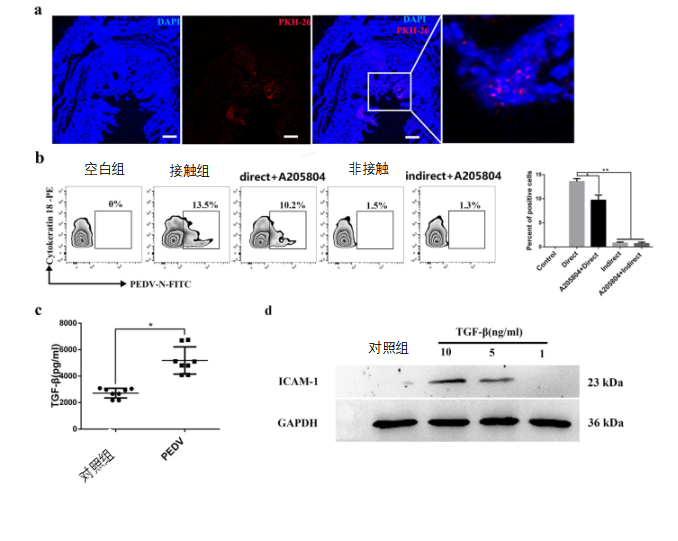
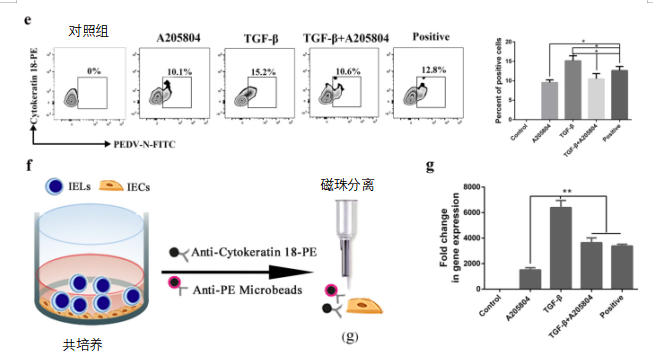
图7 TGF-β在T细胞到肠上皮细胞(IEC)接触介导的PEDV传播中的作用。
(a)从刚分娩的母猪初乳中收集CD3+T细胞。然后用荧光标记物PKH26标记CD3+T细胞并喂给新生仔猪。12小时后,用戊巴比妥钠(100乳腺/kg)麻醉小猪。饲喂荧光标记细胞组的空肠冷冻切片用DAPI(蓝色)染色并通过荧光显微镜观察。(b)研究携带PEDV病毒的CD3+T细胞向肠上皮细胞(IECs)传播的模型。通过两种方法(接触和非接触共培养)将携带PEDV的CD3+T细胞与肠上皮细胞(IECs)共培养3h,并与或不与ICAM-1抑制剂A205804(50ng/mL)共培养。从共培养系统中收集细胞,并通过流式细胞仪(FACS)检测细胞角蛋白-18。(c)通过ELISA测定母猪(对照组和感染组)初乳中TGF-β的水平。(d)通过MACS分类的肠上皮细胞(IECs)在有或没有TGF-β的情况下培养2小时。Western blotting测定ICAM-1和GAPDH的水平。(e)用浓度为5ng/mL的TGF-β处理或不处理肠上皮细胞(IECs)。
PEDV脉冲CD3+T细胞通过接触法与肠上皮细胞(IECs)共培养3小时,并与ICAM-1抑制剂A205804共培养或不与ICAM-1抑制剂共培养。从共培养系统收集细胞,通过流式细胞仪(FACS)检测肠上皮细胞(IECs)和细胞角蛋白-18。(f)用或不用TGF-β治疗肠上皮细胞(IECs)。用接触法将PEDV脉冲化的CD3+T细胞与肠上皮细胞(IECs)共培养3h,并与ICAM-1抑制剂A205804共培养或不与之共培养。(g)通过RT-PCR测定来自与肠上皮细胞(IECs)共培养的PEDV脉冲CD3+T细胞的肠上皮细胞(IECs)中病毒的基因水平。所有数据均表示平均值±SD。通过方差分析(ANOVA)(多组)进行比较,*,P<0.05;**,P<0.01。数据来自至少三个独立实验。
建立动物模型,验证母猪体内携带PEDV的T细胞到达乳腺
为了评估血液中携带PEDV的CD3+T细胞是否能够到达乳腺并通过初乳引起新生仔猪感染,我们在母猪中进行了携带PEDV的CD3+T细胞的再融合试验(图8a)。24小时后,在乳腺的基底区(AB)、腺体上部的中心区(CAUB)和乳腺池周围区域(ASGC)发现了CFSE标记的CD3+T细胞。与乳腺腺体上部的中心区和乳腺池周围区域相比,更多CFSE标记的T细胞分布在乳腺的基底区(图8b)。此外,流式细胞仪(FACS)结果显示,在3、12和24小时后,可以在初乳中检测到CFSE标记的T细胞(图8c)。母猪注射PEDV感染的CD3+T细胞24小时后,其初乳观察到可见条带。然而,在对照母猪的初乳样品中未观察到可见条带(图8d)。在母乳喂养的新生仔猪的十二指肠、空肠和回肠中也可以检测到PEDV(图8e)。因此,我们的结果表明,携带PEDV的CD3+T细胞可通过血液循环迁移至乳腺,并通过乳腺上皮细胞(MECs)转运至管腔,导致新生仔猪感染PEDV。
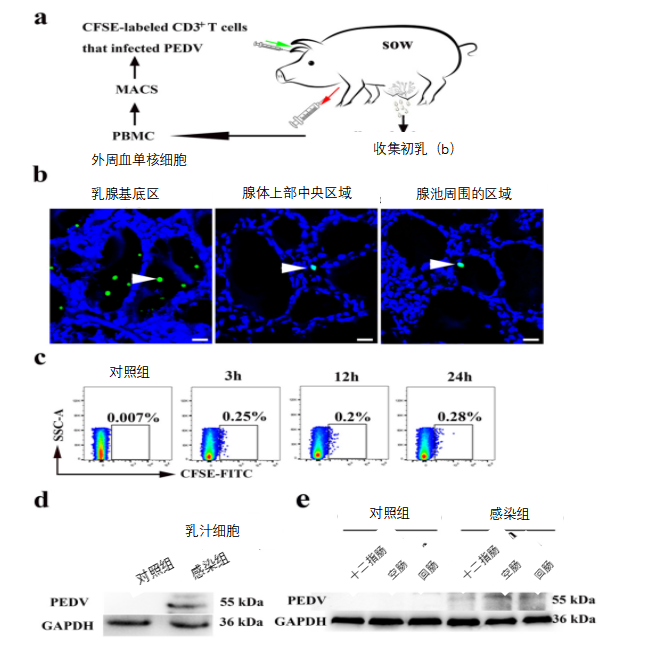
图8 用于验证携带PEDV的CD3+T细胞到达母猪乳腺的动物模型的开发。
(a)研究携带PEDV的CD3+T细胞穿过乳腺上皮细胞并到达初乳的示意图。母猪分娩后,从前腔静脉采集150毫升血液。使用猪外周血淋巴细胞分离试剂盒通过密度离心从血液中分离外周血单核细胞(PBMCs)。通过MACS分离柱从PBMCs中分离CD3+T细胞并用CFSE标记。将感染PEDV的CFSE标记的CD3+T细胞重新悬浮在1ml磷酸盐缓冲盐水(PBS)中,并通过耳静脉注射到母猪血液中。(b)体内自体输血试验后,用DAPI(蓝色)对注射荧光CFSE标记细胞的母猪的乳腺冷冻切片进行染色,包括乳腺基底区(AB)、腺体上部中央区(CAUB)和腺体池周围区域(ASGC)。用CFSE标记的CD3+T细胞用白色箭头标记。标尺=20μm。
(c)对于体内自体输血试验,在不同时间将20ml初乳收集到50ml试管中。初乳中的细胞洗涤两次,并用冰冷的PBS分离。流式细胞仪(FACS)检测CFSE标记的细胞。(d)在24小时体内自体输血试验后,通过使用针对N蛋白的小鼠单克隆抗体的Western blotting法测定初乳细胞中PEDV的蛋白表达。(e)出生24小时后,用针对N蛋白的小鼠单克隆抗体通过Western blotting法测定了母猪哺乳的新生仔猪小肠中PEDV的蛋白表达。
讨论
初乳是许多病毒的重要感染途径,如人类免疫缺陷病毒、寨卡病毒和巨细胞病毒。最近的研究表明,在初乳中可以检测到严重急性呼吸综合征冠状病毒2型RNA。病毒传播来自初乳中的游离病毒和细胞结合病毒。事实上,初乳中细胞结合病毒的存在可能是新生仔猪病毒感染的一个更重要的指示物。因此,初乳中的细胞结合病毒可能成为感染的主要来源。事实上,在我们的研究中,新生仔猪的PEDV感染是由来自初乳的CD3+T细胞介导的。我们的研究证实,PEDV可以通过初乳从母猪传播给新生仔猪,其中CD3+T细胞结合病毒进入初乳发挥了重要作用(图9)。
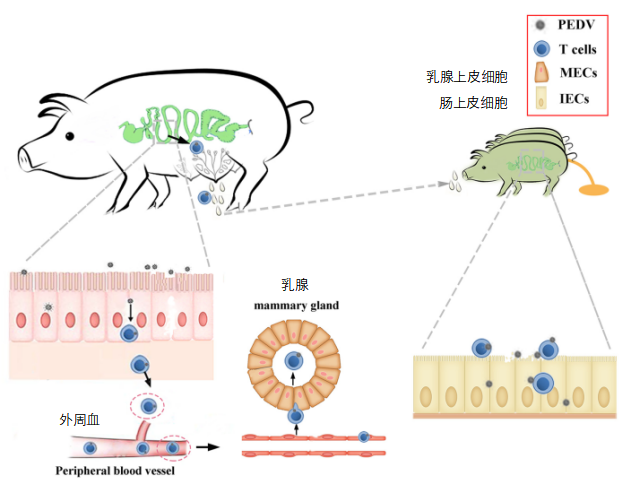
图9 PEDV通过母乳从母猪向新生仔猪的垂直传播的假设机制示意图。
当怀孕母猪返饲(感染野毒)时,母猪可能感染了PEDV。首先,PEDV定植于肠上皮细胞,从而使病毒转移到位于上皮下方的CD3+T细胞。第二,CD3+T细胞携带的PEDV通过淋巴和血液循环从肠道迁移到乳腺。最后,初乳中CD3+T细胞携带的PEDV可以通过细胞间接触将病毒转移到肠道上皮细胞,导致新生仔猪出现典型的PED症状。
PEDV在口服感染母猪后首先定植到肠上皮细胞(IECs)。肠粘膜组织含有大量上皮内淋巴细胞(IELs),这些淋巴细胞位于肠上皮细胞的下方或附近。上皮内淋巴细胞(IELs)由于紧密接触,可以与肠上皮细胞(IECs)进行互联和互通。上皮内淋巴细胞(IELs)也可以从上皮层迁移到固有层,反之亦然。因此,上皮内淋巴细胞(IELs)和肠上皮细胞(IECs)之间的相互作用可能有利于病毒的细胞间转移。事实上,携带PEDV的上皮内淋巴细胞可以通过细胞间接触将病毒传播给CD3+T细胞。然而,PEDV从肠上皮细胞(IECs)转移到上皮内淋巴细胞(IELs)的详细分子机制尚未确定。
淋巴细胞和内皮细胞表面配体和受体的差异表达,以及趋化因子和炎症因子的表达,驱动淋巴细胞迁移。淋巴细胞从肠向乳腺的迁移主要由淋巴细胞表面整合素α4β7和MAdCAM-1之间的相互作用介导。HIV-1病毒粒子包含整合素β4β7,并可被表达MAdCAM-1-的细胞捕获,从而促进HIV-1感染。此外,淋巴细胞的迁移能力可以被病毒调节。这使得受感染的T细胞运动性增强,迁移能力增强,将病毒传播到目标细胞,成为感染的重要来源。
PEDV感染CD3+T细胞后,整合素α4β7水平较高,经口感染PEDV后母猪初乳中MAdCAM-1的表达增加。我们的数据表明,更多携带PEDV的CD3+T细胞可以迁移到乳腺。淋巴细胞的迁移依赖于细胞骨架的重排。病毒可以利用整合素调节肌动蛋白重排,从而促进感染。与另一项研究相似,我们的结果表明,PEDV通过整合素α4β7信号通路影响肌动蛋白细胞骨架重排和辅丝蛋白活性。母猪乳腺中淋巴细胞的跨上皮迁移主要由淋巴细胞上的CCR10介导,并与CCL28相互作用。PEDV感染后CD3+T细胞上CCR10水平较高。经口感染PEDV后,母猪乳汁中CCL28的表达水平增加。
这些数据表明,在PEDV感染期间,更多的CD3+T细胞可以很容易地穿过乳腺上皮进入内腔。我们的数据表明,与CCL28调控免IgA分泌B细胞在哺乳期乳腺中的聚集相一致,T细胞迁移到乳腺也依赖于T细胞上的CCR10和乳腺上皮细胞(MECs)上的CCL28之间的相互作用。尽管这些体外研究使用了多种上皮细胞系作为体外模型,但它们并没有完全再现体内感染的复杂性。
在本研究中,对母猪进行了自体输血实验,证明携带PEDV的CD3+T细胞可以通过血液循环迁移到乳腺,并通过乳腺上皮进入内腔。携带CD3+T细胞的PEDV是否还有其他途径迁移到乳腺,值得进一步探索。这是首次在体内证明PEDV病毒可以借助CD3+T细胞从血液向乳腺迁移。
通过口服接种,感染PEDV的母猪的初乳中携带PEDV的CD3+T细胞可以插入新生仔猪的肠上皮细胞(IECs)之间。这些结果与初乳中的细胞被新生仔猪消化道吸收的结果一致。此外,携带PEDV的CD3+T细胞(母猪初乳)和IECs(新生仔猪)之间发生病毒传播。病毒通过细胞间传播比游离病毒传播更有效,可以使病毒逃避抗体介导的中和作用。
在哺乳的第一天,更多的淋巴细胞迁移到母猪的乳腺中。因此,细胞结合病毒在初乳中的浓度也可能高于常乳,因为前者的淋巴细胞含量高于常乳。我们的结果表明,母猪初乳中PEDV的检出率为44.5%,与另一项研究报告的40.8%的检出率相似。
这项研究不仅揭示了PEDV通过初乳垂直传播的具体机制,还为预防和控制其他病毒在人体内的垂直传播提供了见解。此外,尽管初乳是猪场PEDV感染的主要途径,但避免母乳喂养并不是防止PEDV垂直传播的有效方法。因此,我们建议未来的研究应侧重于阻断垂直传播,避免使用返饲方法,以及开发PEDV疫苗和新生仔猪抗病毒药物。
材料和方法
试剂和细胞系。整合素α4β7、整合素β4和抗CCR10分别从Novus、MyBioSource和Bios公司购买。DyLight 488-和594-共轭二级抗体购自多元科学(Lianke)生物有限公司。抗猪异藻蓝蛋白(APC)-CD3购自BD 生物科学公司。抗PEDV N蛋白单克隆抗体(mAb)购自Medgene实验室。抗猪上皮细胞标记物藻红蛋白(PE)-细胞角蛋白18(CK18)单克隆抗体购自Novus 生物制品公司。TRITC-环肽购自上海酵母生物技术有限公司。重组小鼠MEC CCL28购自Peprotech公司。磷化氢-粘着斑激酶(Tyr397)多克隆抗体(目录号PA5-17084)和磷酸辅酶(Ser3)多克隆疫苗(目录号PA 5-17752)购自Invitrogen公司。
ELISA试剂盒(细胞因子IL-6、TNF-α、IFN-γ、IL-12、IL-10、IL-4和TGF-β)购自江苏美棉实业有限公司有限公司。CFSE(羧荧光素琥珀酰亚胺氨基酯)购自Invitrogen公司。PKH26红色荧光细胞连接试剂盒(PKH26GL)从Sigma Aldrich公司获得。Hoechst-33342是从生命科技公司购买的。抗抗体微球(目录号130-097-054)、抗APC(目录号130-097-143)和免疫磁珠启动试剂盒均购自Miltenyi Biotec公司。Vero E6细胞由大北农集团兽医研究中心提供。EpH4-Ev乳腺上皮细胞由南京农业大学苗金凤提供。细胞系定期检测支原体污染。
试验动物。常规杜洛克×(长白×大白)新生仔猪和母猪是从江西、河北和江苏的四个猪群中获得的。不同农场的母猪在不同的时间饲喂受感染的病料。一般来说,在猪场爆发PEDV后,所有母猪,包括小母猪,都会一次性饲喂受感染的病料,产房内的母猪除外(分娩前21天内)。新生仔猪通过自然分娩出生,喂养合成奶或母猪初乳。每个实验组的新生仔猪被安置在一个单独的房间里,房间内有恒定的湿度和温度,光/暗周期为12小时。在动物身上进行的所有程序和实验均得到南京农业大学动物护理和使用委员会的批准,并遵循国家卫生研究院的动物实验指南。该动物方案经南京农业大学动物资源委员会批准(许可证号SYXK2011-0036)。
试验病毒。我们实验室保存了PEDV野毒株浙江08,该株与新出现的强毒株进行遗传进化树分析。
乳汁中细胞的收集。手动收集20毫升初乳,用于分离细胞。首先通过滤膜(210 mm)过滤样品,然后在4°C下以340×g离心15 min。丢弃带脂肪层的上清液,将细胞颗粒重新悬浮在25mL磷酸盐缓冲液(PBS)中,并重复该流程。然后用巴斯德吸管将最终的细胞颗粒小心地重新悬浮在5 mL PBS中。为了获得T细胞,用APC-CD3抗体标记初乳细胞,用抗APC微球培养,并使用MiniMACS启动试剂盒进行分类。接下来,用植物血凝素(PHA)和IL-2激活分类的CD3+T细胞3天用于PEDV感染(感染多重性[MOI]=0.1)。
PEDV口服接种。采用完全随机设计,将体重相似的新生仔猪(0日龄)分为2组(每组3头),并安置在两个单独的房间内。新生仔猪是从返饲感染的母猪中挑选出来的。新生仔猪PEDV及其抗体呈双重阴性。母猪和仔猪在攻毒后分开饲养。这两组是对照组(第一组)和仔猪饲喂的初乳CD3+T细胞来自返饲感染母猪(第二组)。新生仔猪从自己的分娩母猪那里吸收初乳。第二组新生仔猪通过口服接种1 mL初乳CD3+T细胞进行攻毒。在第I组中,口服相同体积的PBS作为阴性对照。在整个实验过程中,动物每3小时人工喂养一次自己分娩母猪的初乳,以满足或超过国家研究委员会(NRC,2012)对这种大小仔猪的营养和能量要求。攻毒后,每天观察新生仔猪腹泻症状。
T细胞的收集。使用猪外周血淋巴细胞分离试剂盒(Solarbio)通过密度离心法从猪血液中分离出猪PBMCs。从肠系膜淋巴结(MLNs)分离淋巴细胞的方法如下。去除残留的肠系膜脂肪组织后,将淋巴结切成0.5 cm的碎片。在4°C下,在20 mL 10 mM EDTA的Hanks平衡盐溶液(HBSS)中培养20 min。然后离心混合物,将沉淀放入含有1%胎牛血清(FBS)、胶原酶D(Roche)和DNase I(Sigma)各2 乳腺/mL以及100 U/mL Dispase(Fisher)的消化液中,在37°C下缓慢旋转20 min。通过密度梯度离心获得上清液。为了获得T细胞,用APC-CD3抗体标记MLNs中的PBMCs和淋巴细胞,用抗APC微球培养,并使用MiniMACS启动试剂盒进行分类。接下来,PHA和IL-2(Proceth)激活分选的CD3+T细胞3天,以进行后续实验。
PEDV的感染和传播。Vero细胞在37°C下感染PEDV(MOI=1)1小时,并进行彻底清洗以清除未结合病毒。感染PEDV的Vero细胞通过两种方法(接触和非接触)从肠系膜淋巴结(MLNs)中挑选的阳性CD3+T细胞共培养,在添加PHA和IL-2的RPMI 1640培养基中保持37°C,以供后续研究使用。1小时或6小时后,收集携带PEDV的CD3+T细胞,通过RT-PCR和斑块分析测定病毒RNA滴度。Western blotting检测共培养系统CD3+T细胞中PEDV的蛋白表达。
体内回输实验。对于体内回输试验,从PBMC中分离CD3+T细胞,并用PEDV感染3小时。然后,用CFSE(绿色)标记感染PEDV的CD3+T淋巴细胞,以进行长期细胞标记。CFSE标记装载PEDV的CD3+T细胞(5×107),然后通过耳静脉注射过继转移到母猪体内(自体)。注射后24小时处死受体母猪。为了进行流式细胞仪分析,在不同时间从乳中分离细胞。为了进行组织学分析,用0.1 M PBS(pH 7.4)清洗乳腺组织,包括乳腺的基底区域(AB)、腺体上部的中心区域(CAUB)和腺体池周围的区域(ASGC),并将其嵌入OCT化合物中。将乳腺中AB、CAUB和ASGC的冷冻组织切成8 mm的切片,并安装在聚-L-赖氨酸涂层的玻璃载玻片上。用荧光显微镜(卡尔蔡司)观察CFSE标记的细胞。
人工基底膜上的迁移。24孔跨孔板的8 um孔径聚碳酸酯过滤器的下侧涂有100 uL的50% 人工基底膜,并在37°C下固化20分钟。用CFSE标记,感染PEDV,并将106个血源性CD3+细胞/mL接种到人工基底膜上。底室加入含有MAdCAM-1的培养基(500 ng/mL)。血液来源的CD3+细胞在37°C和5% CO2培养24小时。随后,将孔径为8 um的聚碳酸酯过滤器放置在载玻片上进行观察。图像使用蔡司LSM710共聚焦显微镜拍摄。
迁移分析。在24孔跨孔板(Corning Incorporated Costar, Cambridge, MA, USA)的5mm孔径聚碳酸酯过滤器的下侧植入小鼠乳腺上皮细胞(MECs)。通过测量MEC单层的跨上皮电阻(TEER)和用抗ZO-1(Invitrogen)染色紧密连接蛋白(如ZO-1)来评估MEC单层融合。用CFSE标记的淋巴细胞接种到MECs的上腔。将重组趋化因子CCL28(500 ng/mL)和来自对照组或感染组的牛奶添加到一些过滤器的下室。在37°C和5%CO2条件下迁移24小时后,通过下室培养基离心收集T细胞,并通过FACS定量。用荧光显微镜观察滤膜上的细胞迁移情况。使用蔡司LSM710共焦显微镜拍摄图像。
共焦激光扫描免疫荧光显微镜。CD3+T细胞在不同时间感染PEDV(MOI=0.1)。用4%多聚甲醛固定细胞15分钟,用0.1%Triton X-100渗透5分钟。然后,用5%牛血清白蛋白(BSA)封闭细胞1小时,并在4°C下用CD3抗体孵育染色细胞过夜。在PBS中冲洗后,用Alexa Fluor 647标记的二级抗体孵育的细胞在室温下保持1小时。最后,用200 nM TRITC-phalloidin-PBS染色40分钟,用1 乳腺/mL 4',6-二氨基-2-苯基吲哚(DAPI)-PBS染色10分钟,分别标记F-actin和细胞核。然后使用共焦激光扫描显微镜记录荧光图像。
免疫组织化学。通过静脉注射戊巴比妥钠(100 乳腺/kg体重)将猪麻醉并处死。取十二指肠、回肠和空肠,然后选择这些部分,用针对PEDV N蛋白的一抗免疫组化(IHC)评估PEDV的分布。用5%牛血清白蛋白封闭1小时后,随后在4°C下用小鼠抗猪PEDV(1:100)孵育过夜,然后在室温下用生物素化兔抗鼠IgG孵育1小时。用二氨基联苯胺(DAB)染色后,用中性橡胶密封切片。使用放大倍率为×100或×400的光学显微镜(CX23;日本东京奥林巴斯公司)对切片进行可视化。
IFA。固定切片在0.2%Triton X-100中的PBS中渗透5分钟。用PBS洗涤3次后,用5%牛血清白蛋白封闭过滤器1小时。过滤器在4°C下与一级抗体培养过夜,然后在室温下与荧光二级抗体培养1小时。用山羊CD3 mAb和鼠抗PEDV mAb对组分进行免疫标记,其次是Alexa Fluor 594偶联兔抗羊IgG和Alexa Fuor 488偶联山羊抗鼠IgG。
Western blot分析。来自不同组织或细胞的总蛋白,用裂解缓冲液裂解,用SDS-PAGE分离,转移到聚偏乙烯膜(Millipore)上。用含有5% BSA和0.1%吐温-20的tris-缓冲盐水阻断膜。接下来,将膜与各自的一抗孵育,然后用阻断试剂中的辣根过氧化物酶(HRP)偶联二抗体孵育。用tris-缓冲盐吐温(TBST)广泛洗涤后,增强化学发光(ECL)反应后通过薄膜曝光分析免疫反应条带。
菌斑分析。通过菌斑试验测定上清液样本的病毒滴度。将生长在12孔组织培养板中的Vero细胞汇合单层感染500 uL连续10倍稀释的上清液样本。在37°C下培养1小时后,在含有2%FBS的Dulbecco改良Eagle’s培养基(DMEM)中覆盖0.7%琼脂糖,并在37°C.下培养细胞。感染后3天,用结晶紫染色可见斑块。
流式细胞术分析。细胞取自不同的粘膜,并用所示抗体染色。表面染色后,将细胞重新悬浮在固定/渗透溶液(BD-Cytofix/Cytoperm试剂盒;BD-Pharmingen)中,在4°C下悬浮40分钟,并用PEDV N蛋白抗体染色,以检测细胞内PEDV。用PBS洗涤三次后,用FACS(BD-FACSCalibur)对细胞进行表型分析。
通过酶联免疫吸附试验进行细胞因子分析。通过酶联免疫吸附试验(ELISAs)分析牛奶中的细胞因子水平,并通过ELISA检测牛奶中的PEDV特异性IgA抗体和血清中PEDV特异性IgG抗体。根据制造商的说明,使用ELISA试剂盒测量细胞因子IL-6、TNF-α、IFN-γ、IL-12、IL-10、IL-4和TGF-β的产生。
RT-qPCR。根据制造商的说明,使用RNAiso plus试剂盒(TaKaRa,大连,中国)纯化来自不同组织的总RNA。以新鲜RNA (500 ng)为模板,使用Prime Script II第一链cDNA合成试剂盒(TaKaRa,大连,中国),用商业寡核苷酸(dT)引物合成第一链cDNA。PCR采用SYBR绿色qPCR试剂盒(TaKaRa),采用Applied Biosystems 7500快速实时PCR系统(Life Technologies)。用单独的甘油醛-3-磷酸脱氢酶(GAPDH)扩增来规范基因表达。数据分析采用2-ΔΔCT方法。
统计分析。结果以平均值±标准差(SD)表示,并用SPSS 17.0进行分析。采用单向方差分析(ANOVA)确定多组之间的显著差异,并采用t检验确定两组之间的差异(*,P<0.05;**,P<0.01)。除非另有说明,否则数据来自至少三个独立实验。