
2017年12月,新型猪瘟E2亚单位疫苗”天瘟净”成功问世,引发热议,E2疫苗在防控猪瘟的过程中起到了什么作用呢?本期推荐的译文来自国立中兴大学兽医学院兽医病理研究所黄千衿教授课题组的一篇新作。该文章结果证明猪瘟E2亚单位疫苗能够克服猪瘟弱毒疫苗的主要缺陷,能提高疫苗免疫效力来更好地净化猪瘟,也为猪瘟E2亚单位疫苗的使用提供了有价值的指导。

该篇译文有如下几个重要发现:
1、猪病学描述的猪瘟E2疫苗母猪使用后不能阻断垂直感染,主要原因是产生的中和抗体太低。但是一个好的猪瘟E2疫苗,是能够产生高水平的中和抗体,从而阻断病毒传播,实现阻止感染的能力。
2、猪瘟E2疫苗确能够克服母抗的干扰,仔猪1针免疫的效果好于活苗2针。
3、母猪使用猪瘟E2疫苗,仔猪可以用猪瘟E2疫苗或者猪瘟活苗,但是用活苗,一定要推迟到12周左右再免疫,回避母抗的干扰。
4.、猪瘟活苗2次免疫仍有缺陷的,不是对抗母抗干扰的最佳方法。而猪瘟E2疫苗一次就能克服母抗的干扰。
5. 猪瘟活疫苗对怀孕母猪的安全性一直是个有争议的话题。台湾猪场为了回避这个问题,猪瘟活苗固定在母猪配种前免疫。随之而来的问题包括临产母猪和断奶仔猪的猪瘟抗体参差不齐,仔猪猪瘟活苗的首次免疫时机顾此失彼,母抗干扰无法克服,上市肥猪猪瘟抗体阴性比例增加。
无独有偶,过去5年的用户体验中,相较于猪瘟活苗,天瘟净在猪瘟深度防控和轻松净化上也让用户体验到了以上优势, 具体表现为:
①天瘟净在母猪免疫上,能够克服既有抗体的干扰,每一次免疫都能再度提升猪瘟抗体水,抗体更高、更整齐、更持久。
②天瘟净在仔猪的免疫上,能够克服母源抗体的干扰,一次免疫就能全部转阳,抗体持续增加6-8周,抗体阳性维持到上市。
③天瘟净在后备母猪的免疫上,一次免疫就能抗体全部合格(高于50%阻断率),包括那些猪瘟活苗免疫2次仍不合格(低于50%阻断率)的后备母猪。
④ 针对猪瘟活苗往往没有免疫效果的亚健康猪群(蓝耳感染、伪狂犬感染、圆环感染的保育猪最为典型),天瘟净一次免疫能够实现猪瘟抗体转阳,提升猪瘟基础健康水平。
⑤ 天瘟净开创了猪瘟免疫程序的极简时代(211工程):母猪每年只需普免2次、商品猪1次、1毫升上市;
⑥天瘟净和天康口蹄疫、伪狂犬等疫苗的联合免疫,一次免疫防控3种疾病,进一步给客户免疫减负和提升效益。
⑦天瘟净作为一个鉴别诊断疫苗,配合E0试剂盒或者PCR检测,能够更好的锁定猪瘟野毒感染猪群,进行早期干预和适当淘汰,快速实现和维持、监测猪瘟净化的状态。天瘟净不仅仅是一种疫苗,更是一种新的检测工具。
临床应用中猪瘟E2(CSF-E2)亚单位疫苗阻断猪瘟病毒传播的效力和母源抗体对其效力的干扰的评估
Evaluation of classical swine fever E2 (CSF-E2) subunit vaccine efficacy in the prevention of virus transmission and impact of maternal derived antibody interference in field farm applications
全文链接:
https://doi.org/10.1186/s40813-020-00188-6
摘要
背景:猪瘟(CSF)是最具破坏性的影响全球养猪业的猪病之一。除了扑灭根除政策外,使用猪瘟弱毒疫苗或猪瘟E2亚单位疫苗进行免疫也是一种疾病控制的有效措施。然而,经过几十年的努力,仍然很难根除地方性感染地区和复发地区的猪瘟。之前的大多数证明猪瘟疫苗效力的研究是在高度封闭的实验室条件下完成的,这不能代表其在田间应用中的实际效果。由于一些不可控因素造成疫苗效力不足,可能导致慢性或持续性猪瘟感染猪只的出现,成为猪群中猪瘟病毒排毒的主要来源。本研究中使用无特定病原体(SPF级)猪的进行免疫-攻毒-同居试验以及对常规母猪及其后代进行长期监测来评估临床应用中猪瘟疫苗的效力和母源抗体(MDA)对其效力的影响。
结果:试验表明,猪瘟E2亚单位疫苗免疫攻毒组的中和抗体(NA)滴度更高,没有临床症状和明显的病理变化。此外,在同居期间没有一只哨兵猪被感染,这表明猪瘟E2亚单位疫苗能使猪只获得足够好的免疫力来阻止病毒的水平传播。在田间试验中,与免疫猪瘟弱毒疫苗的母猪相比,免疫猪瘟E2亚单位疫苗的母猪有更高且更一致的平均抗体水平,唾液中病毒 RNA含量显著减少,而活疫苗免疫的母猪的抗体水平参差不齐且唾液中病毒RNA的含量更高。此外,猪瘟E2亚单位疫苗在对3周龄仔猪进行初次免疫时不受到母源抗体干扰,并且产生的抗体水平整齐、持久,这表明猪瘟E2亚单位疫苗在免疫方案设定时能够更加灵活。
结论:猪瘟E2亚单位疫苗免疫妊娠母猪和仔猪均显示出更好的效力且不受母源抗体干扰。这些优点给猪场防控猪瘟提供了一种新的方法来避免母猪群中可能的排毒和仔猪群中母源抗体对疫苗效力的干扰。
关键词:猪瘟、猪瘟E2亚单位和猪瘟弱毒疫苗、母源抗体、唾液监测、病毒 RNA检测、免疫-攻毒-同居试验
背景
猪瘟(以前称为猪霍乱)是世界范围内最具破坏性和跨境的猪病毒性疾病之一。猪瘟由经典猪瘟病毒引起,一种有囊膜的单股正链RNA病毒。猪瘟病毒基因组拥有一个编码多蛋白的开放阅读框,该多蛋白经过宿主细胞或病毒蛋白酶的转录修饰和转录后修饰产生结构(Core、Erns、E1、E2)或非结构(Npro、P7 , NS2, NS3, NS4A/B, NS5A/B)蛋白质。猪瘟病毒毒株的毒力分为三个等级(低、中、高),与不同的临床进展和诱发的病理病变有关。此外,根据猪瘟病毒毒力的多样性和感染猪引发的炎症反应,猪瘟感染的病程可分为急性感染、慢性感染和持续感染。急性猪瘟,在感染高毒力猪瘟毒株的早期出现,症状包括高热、厌食、结膜炎、白细胞减少、血小板减少和大量出血和淋巴结肿大。感染后2至4周内可观察到死亡,死亡率可高达100%。然而,感染中等或低毒力猪瘟毒株的猪可能会发展为慢性感染或持续感染,其临床症状不明显,很难通过临床诊断来鉴别。事实上,感染慢性或持续感染的猪瘟的猪只可能会留在猪场,直到被屠宰后上市。据推测,这些受感染的猪是猪瘟病毒的主要来源,并且在猪场连续或间歇性地排出病毒,导致健康猪群的高感染风险。
免疫疫苗是流行地区控制和预防猪瘟暴发最有效的策略之一。将强毒力猪瘟病毒通过在兔、豚鼠或细胞系中进行一系列传代获得几种猪瘟弱毒疫苗,这些弱毒疫苗已在猪场使用了数十年。已经证明,猪瘟弱毒疫苗最早可在免疫疫苗后5天提供保护效果,并诱导体液免疫以实现长期保护。然而,疫苗批次的稳定性、运输过程中的冷链缺失、疫苗免疫过程中混合感染或继发感染其他病原体以及母源抗体的干扰等问题,可能导致不同地区或国家的疫苗接种效果不同。这些弱毒活疫苗的使用导致很难区分猪瘟野毒感染的猪和弱毒 免疫的猪。此外,最近的研究表明,由于中低毒力毒株在猪场的循环,弱毒疫苗诱导的免疫在临床应用中可能无法根除这些病毒。疫苗诱导的不完全免疫反应对于病毒进化是一种正向选择。因此,尽管使用猪瘟弱毒疫苗有效地减少了猪瘟爆发,但仍需要评估其在猪场应用中的生物安全性和病毒根除能力。
几种基于囊膜糖蛋白E2 (猪瘟-E2) 的亚单位标记疫苗已经被研究和讨论过,猪瘟E2蛋白是诱导猪瘟中和抗体的主要抗原。以前的研究主要在高度封闭条件下进行免疫-攻毒模型来评估猪瘟E2亚单位标记疫苗的效果。许多概念性疫苗在实验室已被充分研究,但只有少数已获准用于猪场,而聚焦于猪场应用的研究很少见,尤其是聚焦母猪及其仔猪的。因此,我们通过使用SPF猪作为哨兵动物进行了免疫-攻毒-同居试验,以评估猪瘟E2亚单位疫苗对抵御高毒力猪瘟病毒的效力及其减少病毒水平传播的能力。此外,还评估了高母源抗体水平对猪瘟E2亚单位疫苗或猪瘟弱毒疫苗效力的影响,以评估猪场的疫苗效力和疫苗接种策略。
方法
动物和猪场选择
10头6周龄SPF猪购自台湾苗栗农业技术研究所动物技术实验室,用于免疫攻毒实验。本研究选择了位台湾台中的一个从出生到育肥的连续生产猪场。猪场里有150头长白-约克夏母猪和2000头长白-约克夏-杜洛克猪。每头母猪平均产仔数为11,每窝平均断奶数为10。每头母猪每年平均饲养仔猪数为19.8。猪场常规使用猪瘟弱毒疫苗(Lapinized Philippines Coronel株,LPC疫苗)来预防猪瘟的爆发。基于加强疫苗免疫程序,猪场中的后备母猪和保育猪分别在6周龄和9周龄时免疫了2次LPC疫苗。母猪在配种前常规免疫1次LPC疫苗。除 LPC疫苗外,母猪常规免疫猪圆环病毒2型(PCV2)、伪狂犬病和萎缩性鼻炎疫苗,仔猪免疫PCV2、萎缩性鼻炎、地方性肺炎和伪狂犬病疫苗以预防疾病。在这个传统猪场中没有发现猪瘟爆发记录。研究中的所有都自由采食,并在高度封闭动物生物安全级别 II(ABSL-2)单元(SPF猪)或最初的来源猪场(常规猪)中饲养。所有动物试验和实验程序均由国立中兴大学机构动物饲养管理与应用委员会 (IACUC) 审查和批准,IACUC批准号为98-64和105-005。
猪瘟疫苗
本研究使用猪瘟E2亚单位疫苗(Bayovac® CSF-E2疫苗,拜耳台湾公司)和LPC疫苗(冷冻干燥的猪霍乱疫苗,台湾动物卫生研究院)。每种疫苗以1头份(2mL)免疫,在猪耳朵后面的颈部进行肌内注射。为了评估猪瘟E2亚单位疫苗的效力,对SPF猪进行了免疫-攻毒试验(试验I)。其他三项试验(试验II-IV)包括对母猪和仔猪的监测,旨在评估猪瘟E2亚单位疫苗在猪场的应用(图1和表1)。
动物试验设计
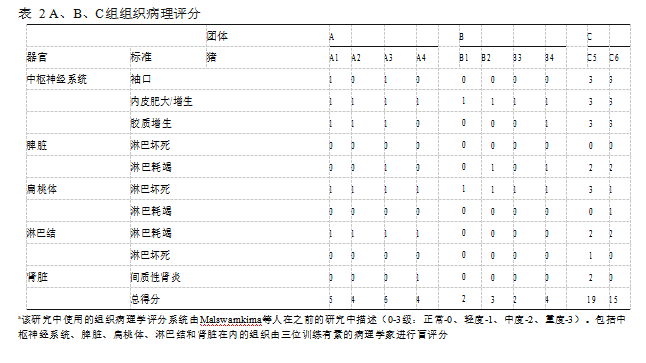
在试验I中,评估了猪瘟E2亚单位疫苗在减少猪瘟病毒水平传播方面的效力。10头6周龄SPF猪用于免疫-攻毒试验并随机分配到三组。A组猪(n = 4)在6周龄和9周龄时免疫了猪瘟E2亚单位疫苗。免疫3周后,猪在12周龄时肌内注射1×10550%组织培养感染剂量(TCID50)的高毒力猪瘟ALD毒株。攻毒4天后,哨兵猪(B组,n = 4)被转移到与A组同居以评估病毒水平传播。对照组C的猪(n = 2)在6周和9周龄时免疫了安慰剂后,与A组相同的也用1×105TCID50的猪瘟ALD毒株进行攻毒。C组的猪由于严重的临床症状在攻毒后(DPC)第7天被安乐死。A组和B组的存活猪在攻毒后第25天时被安乐死以进行病理学检查。尸检时收集中枢神经系统(大脑和小脑)、脾脏、扁桃体、淋巴结和肾脏,并固定在10%中性福尔马林中以进行显微镜检查。石蜡包埋的组织切片由三名训练有素的病理学家根据Malswamkima等人在先前研究中描述的组织病理学评分系统进行检查和盲评分(0-3 级:正常-0、轻度-1、中度-2,严重-3)。在猪瘟攻毒(第0天)和攻毒后第4、7、12、17和25天收集乙二胺四乙酸(EDTA)抗凝血和血清样品。由于白细胞减少和血小板减少是急性猪瘟病毒感染的特征性表现,因此使用 ProCyte Dx™(IDEXX Laboratories, Inc., Westbrook, ME, USA)对EDTA抗凝血进行全血细胞计数。白细胞计数低于11×103个细胞/μL和血小板计数低于211×103个细胞/μL被认为是白细胞减少症和血小板减少症。血清样品用于分析猪瘟病毒特异性中和抗体水平和病毒血症水平。
在试验II中,来自传统养猪场的60头母猪在配种前进行常规LPC疫苗免疫后随机分为两组以便分析猪瘟E2亚单位疫苗(D组,n = 25)和LPC疫苗(E组,n =35)诱导的免疫反应。D组母猪在分娩前3周和5周免疫2次猪瘟E2亚单位疫苗,而E组母猪在配种前按照常规猪原免疫程序免疫1次LPC疫苗。在疫苗免疫当天(第0天)和1个月(第30天)每隔3天用棉棒从每组5头母猪(共10头母猪)中采集唾液样本。分娩后3天收集D组和E组母猪的血清样本,用于分析猪瘟特异性抗体水平作为预期的母源抗体水平(图1)。此外,对每组的后代进行监测,以描述母源抗体的下降情况。D组5头母猪的猪瘟特异性抗体阻断率超过85%的后代被分配到F组(n = 20,每窝4头仔猪),E组5头母猪的猪瘟特异性抗体阻断率超过85%的后代被分配到G组(n = 20,每窝4头仔猪)。F组和G组的仔猪未免疫疫苗,在第1、4、8 和 12周龄时采集血清样本,监测获得性免疫和母源抗体水平的下降情况。
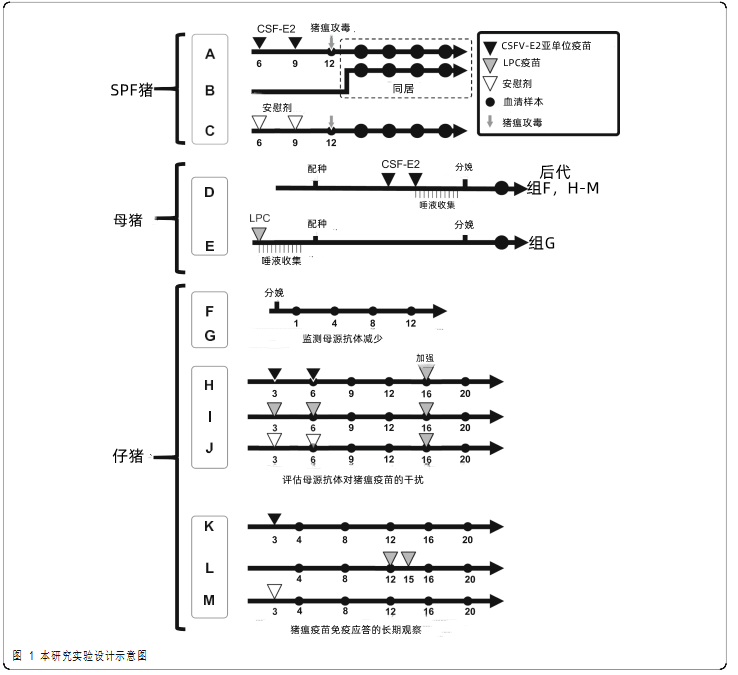
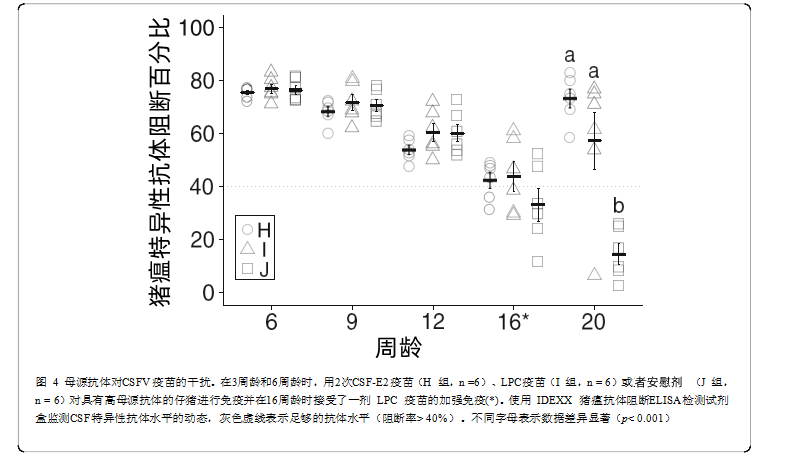
在试验III中,来自D组的18头具有高猪瘟特异性抗体水平(3周龄时平均阻断百分比为88.89% ± 0.94%)的仔猪被随机分配为三组并用猪瘟E2亚单位疫苗(H组, n = 6)、LPC疫苗 (I组,n =6) 或安慰剂 (J组,n =6) 进行免疫并在3周和6周龄时对母源抗体在疫苗诱导的免疫反应中存在的潜在干扰进行评估(表1)。在6、9、12、16和20周龄时收集血清样本,并监测猪瘟特异性抗体水平。由于考虑到生物安全性,试验III中的所有猪在16周龄时都免疫了LPC疫苗,以模拟传统猪群中慢性或持续性猪瘟病毒感染可能造成的污染。加强免疫4周后,筛选猪瘟特异性抗体水平,以评估和阐明高水平母源抗体对猪瘟疫苗诱导的免疫反应的干扰。
在试验IV中,在猪场应用中进行的猪瘟疫苗诱导的免疫反应是从断奶到育肥阶段进行长期观察的。来自D组的30头小猪被随机分配为三组(表1)。K组(n = 10)在3周龄时免疫1次猪瘟E2亚单位疫苗,L组(n = 10)在12周和15周龄时免疫2次LPC疫苗。M组(n = 10)在3周龄时注射一次安慰剂并作为对照组。在4、8、12、16和20龄时收集血清样本,并监测猪瘟特异性抗体水平。
表1研究中的猪群和实验方案
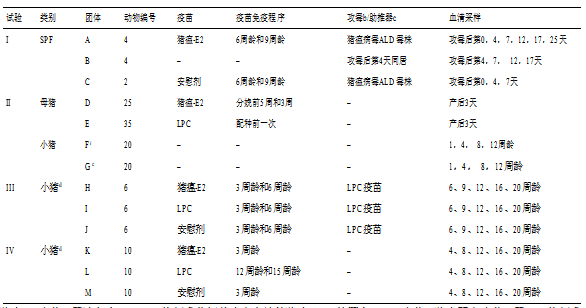
a猪瘟-E2疫苗,用油包水(W/O)佐剂乳化杆状病毒表达的猪瘟-E2亚基蛋白;LPC疫苗、猪瘟弱毒疫苗;用W/O佐剂乳化生理盐水构成的安慰剂
bA组和C组猪在12周龄时在耳后颈部肌肉内注射1 ×105 TCID50猪瘟病毒(ALD菌株)
cH-J组猪在16周龄时用一剂LPC疫苗作为加强免疫
dD组5头母猪的猪瘟特异性抗体阻断率超过85%的后代被分配到F组(每窝4头仔猪)
e来自E组的5头母猪的猪瘟特异性抗体阻断率超过85%的后代被分配到G组(每窝4头仔猪)
通过荧光定量PCR检测猪瘟RNA
使用NucleoSpin® RNA试剂盒(740955.50, Macherey-Nagel GmBH & Co. KG, Duren, Germany)提取血清 RNA,并使用RNAzol®RT(R4533, Sigma-Aldrich, St. Louis, MO, USA)提取唾液RNA,随后使用iScript cDNA 合成试剂盒(1708891,Bio-Rad,Hercules,CA,USA)对所有RNA样品进行反转录。Hoffmann等人在2005的研究中描述并验证了针对猪瘟病毒5'UTR序列的荧光定量PCR测定。使用LightCycler®480仪器(Roche diagnosticGmBH, Mannheim, Germany)进行实时PCR,并使用1.5版的LightCycler®480软件(Roche生命科学)计算每个反应的交叉点(Cp)值,并将量化数据进行Log10转换以供分析。
检测猪血清样本中的猪瘟特异性抗体
根据OIE(世界动物卫生组织)的诊断手册,使用荧光抗体病毒分析进行针对LPC毒株的猪瘟病毒特异性中和抗体水平测定,中和抗体水平进行Log2转换分析。根据Terpstra等人(1988)的说法,中和抗体水平低于12.5的猪不能预防疾病和死亡,中和抗体水平在12.5和30之间的猪可以从病毒攻击中存活,但不足以避免散毒,而中和抗体水平大于1:32的猪是被认为足以保护个体和防止散毒。还可以使用IDEXX猪瘟抗体检测试剂盒(IDEXX Laboratories Inc.,Liebefeld,Switzerland)—一种竞争性ELISA试剂盒分析血清猪瘟特异性抗体水平,结果大于40%的阻断率被认为是阳性且能预防猪瘟病毒感染(附加文件1:图S1)。
统计分析
计算唾液猪瘟RNA的阳性率使用带有Yate连续性校正的Pearson卡方检验进行统计分析。血清抗体水平表示为平均值±平均值的标准差。抗体水平的变异系数(CV)以百分比表示,以代表各组抗体水平的变化。Welch的双样本t检验用于评估试验II中组间的抗体水平。在试验III和IV中,采用单向方差分析和Tukey posthoc检验来评估组间的抗体水平。使用3.6.1版的R软件(The R Foundation,Vienna,Austria),进行数据分析且由于p值小于0.05被认为差异显著。
结果
猪瘟E2亚单位疫苗可以保护猪免受猪瘟病毒攻击并完全防止水平传播
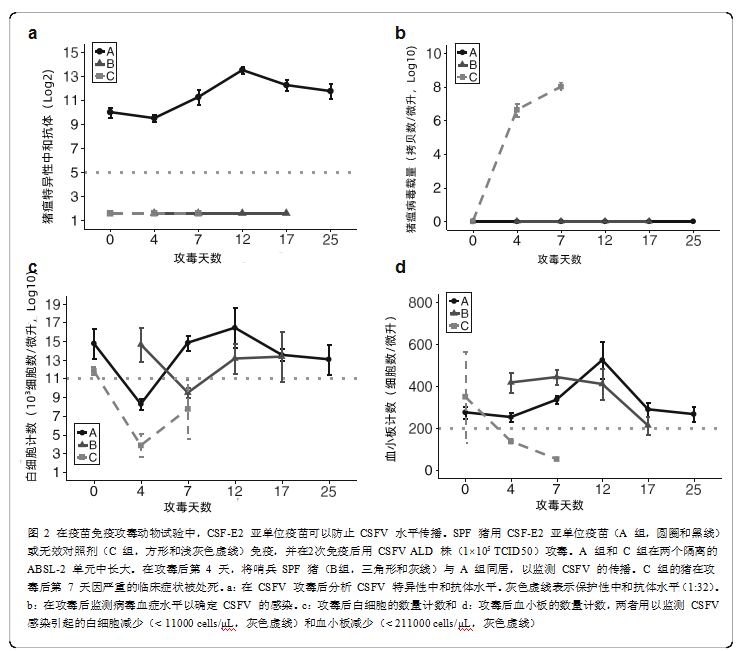
猪瘟E2亚单位疫苗的效力在使用SPF猪的疫苗免疫-攻毒试验中得到证实。在6周龄和9周龄时,A组猪用猪瘟E2亚单位疫苗免疫,C组猪用生理盐水免疫。免疫疫苗后,A组和C组的猪在12周龄时接受高毒力猪瘟ALD毒株的攻毒。B组的猪是哨兵动物,在攻毒后第4天时被转移到A组同居,以评估猪瘟病毒的传播。病毒攻击后,C组猪的耳尖和腿尖出现紫绀且在攻毒后第7天的尸检中发现了几个特征性的病理发现(附加文件1:图S2和图S3)。显微镜检查结果显示A组和同居哨兵猪B组的组织病理学评分较C组低,表明猪瘟E2亚单位疫苗具有保护效果(表2)。A组(10.00±0.41log2,攻毒前)的猪在2次免疫后显示出比C组(1.59±0.00log2,攻毒前)显著更高的猪瘟病毒特异性中和抗体水平。在猪瘟病毒ALD毒株攻毒后,A组显示出明显的抗体增加,从攻毒后第4天(9.50 ±0.29log2)到第12天(13.50 ±0.29log2),而在B组和C组中未发现抗体反应(图2a)。C组的病毒载量从0(阴性)到攻毒后第7天(8.00 ± 0.25 log10)显著增加,代表已感染猪瘟病毒。相比之下,在攻毒前和到攻毒后第25天(整个实验期间)A组猪(猪瘟E2亚单位疫苗免疫的猪)中未检测到的病毒血症。更重要的是,哨兵猪在整个实验期间没有显示出感染的临床症状,也没有检测到病毒血症,这表明猪瘟-E2免疫猪可以防止猪瘟病毒攻毒后的水平传播(图2b)。A组(8.28±0.61×103个cells/μL)和C组(3.85±1.25×103个cells/μL)在攻毒后第4天白细胞计数减少,表明猪瘟病毒感染对猪的影响(图2c)。A组猪的白细胞计数在攻毒后第7天迅速恢复表明产生了疫苗诱导的保护性免疫反应,而C组的猪保持白细胞减少状态。此外,C组病毒攻毒后第4天的血小板数量急剧下降(52.50 ± 3.50 ×103个cells/μL),这可能与肾脏和回盲部瓣膜上的出血病变有关(图2d和附加文件1)。
猪瘟E2亚单位疫苗在母猪中诱导更强和更一致的免疫反应,以提供持久的母源抗体
为评估猪瘟病毒疫苗免疫方案的可行性,D组母猪在分娩前3周和5周免疫猪瘟E2亚单位疫苗,而E组母猪继续进行常规猪场的普通LPC疫苗免疫程序。在D组和E组免疫中未发生与猪瘟疫苗相关的生殖问题和任何不良反应。在分娩后3天,D组母猪(88.75% ± 2.54%)的抗体水平显著高于E组(71.66 ± 24.28;p<0.05)(图3a)
D组的变异系数(2.86%)低于E组(33.88%),表明经瘟E2亚单位疫苗免疫母猪的抗体水平分布更一致。此外,母猪唾液猪瘟RNA的检测可能揭示病毒在猪场存在的垂直传播。用猪瘟E2亚单位疫苗免疫后,D组母猪的猪瘟RNA阳性率(6.00%)明显低于E组(42.00%;p< 0.001)(图3b)。
初乳的被动免疫对于仔猪在哺乳到断奶阶段预防病原体感染至关重要,断奶后被动免疫可能会逐渐下降。监控母源抗体动力学已被广泛应用于猪场弱毒疫苗的免疫方案。F组仔猪(D组猪瘟E2亚单位疫苗免疫母猪的后代)的猪瘟特异性抗体水平显着高于G组仔猪(E组LPC疫苗免疫母猪的后代),即1周龄(89.73%±0.33% 和79.92%±1.76%),4周龄(88.89±0.94% 和40.41%±2.31%)以及8周龄(62.68%±5.88% 和29.33%±2.57%)(图3c)。F组的母源抗体在12周龄时逐渐下降至37.08%±3.70%的低水平(图3c)。

高水平的母源抗体不干扰猪瘟E2疫苗诱导的免疫反应
在试验III中,评估了母源抗体对猪瘟疫苗诱导的免疫反应的干扰。将来自母源抗体水平较高的D组(平均阻断率88.94% ±0.94%)的小猪随机分为三组,分别在3周龄和 6周龄时免疫2次猪瘟E2单位疫苗(H组)、LPC疫苗(I组)或安慰剂(J组)。试验III中的所有猪在16周龄时都免疫了1次LPC疫苗。监测猪瘟特异性抗体的动态水平以比较不同猪瘟病毒疫苗诱导的免疫记忆。LPC加强疫苗免疫后,H组(72.94%±3.56%,CV 11.95%)和I组(57.21%±10.82%,CV 40.31%)的猪在20周龄时猪瘟特异性抗体水平显著高于J组(14.38% ± 3.89%,CV 66.29%)(图4)。尽管H组和I组的抗体水平平均值足够,并且在20周龄时未发现统计学差异,但H组猪在加强免疫后迅速进行血清转化,而I组6头猪中的一只没有表现出对LPC加强疫苗的反应,表明母源抗体对LPC疫苗诱导的免疫反应有影响。
从断奶到育肥阶段长期观察猪瘟E2亚单位疫苗在猪场中的应用
在试验IV中,评估了猪瘟E2亚单位疫苗或与LPC疫苗组合的免疫反应。将猪瘟E2亚单位疫苗免疫母猪(D 组)的30头仔猪随机分为三组(每组10头),K组在3周龄时免疫1次猪瘟E2亚单位疫苗、L组在12周龄和15周龄时免疫2次LPC疫苗以及M组在3周龄时免疫1次安慰剂。在3周龄时,三组间猪瘟特异性抗体水平无统计学差异(K:80.50% ±1.06%;L:78.98%±0.95%;M: 71.03% ± 5.19%),且所有仔猪的母源抗体水平相当。与K组和L组相比,M组的抗体水平在实验期间抗体显著降低,分别为12周龄(K:65.11% ± 2.95%;L:65.52% ± 7.27%;M: 49.31% ± 5.73%),15周龄 (K:76.35%±2.37%;L:44.34%±2.35%;M:20.96%±3.69%)和20周龄 (K: 85.60% ±2.43%; L: 72.39% ±2.77%; M:17.70% ± 2.22%)。K组在16和20周龄时的抗体水平明显高于L组。在观察期间,K组所有仔猪的抗体水平较高且一致,表明猪瘟E2亚单位疫苗的保护效果是充足的。L组中的2头猪(总共10头)在12周龄和16周龄时抗体水平不足,可能面临感染野毒株的风险(图5)。

讨论
猪瘟是对全球养猪业最具历史意义和最具破坏性的猪病之一。猪瘟的爆发可能会给包括从散户、小型猪场到大规模猪场等在内的不同生产体系下的养猪业带来巨大的社会经济损失。一旦疾病暴发,流行国家需要很长的过程才能被世界动物卫生组织 (OIE)认定为无猪瘟并重返世界贸易市场。在许多流行地区,使用猪瘟弱毒疫苗进行免疫是防止经济损失的重要部分,已列入国家控制程序。2015年,日本在成功开展10年根除程序后,被OIE正式宣布无猪瘟并被列入无猪瘟国家名单;然而,最近报道了几起从野猪传播给家猪的零星传染。此外2014年在幼猪身上免疫猪瘟弱毒疫苗(LOM株)后,在韩国济州岛意外地再次出现猪瘟。济州岛野毒株(Jeju LOM毒株)和LOM疫苗毒株的全基因组序列比对显示核苷酸(98.7-99.0%)和氨基酸序列(98.9-99.2%)高度一致。在SPF猪和怀孕母猪中进行的免疫试验表明,Jeju LOM株具有LOM疫苗株的大多特性,可能会导致胎儿持续感染。因此,在猪场应用中应更多地考虑弱毒疫苗的安全性。这一巧合证实猪瘟确实是一种高度传染性和特异的传染病,它长期存在于猪场和野外。
猪瘟弱毒疫苗可有效降低经济损失,可防止生猪严重临床症状或死亡,然而,其效力可能受几个因素的影响。疫苗效力不完全可导致病毒从免疫猪身上逃逸,并作为一种筛选压力加速病毒进化。其他缺点主要包括由于母猪母源抗体偏差导致的仔猪疫苗免疫方案不同、对弱仔的不利影响以及免疫期间同时感染PRRSV(猪繁殖与呼吸综合征病毒)、PCV2或细菌病原体的干扰,所有这些极大地影响了猪场的疫苗效力。因此,当使用猪瘟弱毒疫苗在流行地区消除病毒时,可能会遇到很大困难。
先前的多个研究已经揭示了多种基于猪瘟E2亚单位蛋白的非感染性标记疫苗的效力。其中,在接触性感染后备母猪实验中,一个先前上市的亚单位标记疫苗(Porcilis® Pesti,英特威公司)的不完全的保护效力导致了猪瘟野毒的垂直传播。其实,该研究中在接触感染前免疫疫苗的后备母猪的平均中和抗体水平低于4 log2,这的确不足以防止病毒在猪群中传播。而在我们的研究中,含有更高含量和纯度的抗原配合指定的佐剂乳化而成的猪瘟E2亚单位疫苗在预防病毒传播方面具有全面的保护作用。在试验I中,用猪瘟E2亚单位疫苗免疫的猪在免疫2次后达到10log2的足够高的中和抗体水平,并且在1 ×105 TCID50高毒力猪瘟病毒攻击后未显示出临床症状,未检测到病毒血症和病理变化,表明猪瘟E2亚单位疫苗具有完全的保护效力。
根据临床病理学检查,所有经猪瘟病毒攻毒的猪在第4天时观察到白细胞数量下降,而猪瘟E2免疫猪在第7天时白细胞数量迅速恢复,这表明猪瘟E2亚单位疫苗可以更快地激发保护性免疫。猪瘟病毒攻毒对猪瘟E2亚单位疫苗免疫猪的血小板活性没有影响,但在对照组猪中发现了严重的血小板减少症(图2)。未免疫疫苗攻毒猪的血小板减少可能与典型的火鸡蛋状肾出血或代表急性猪瘟病毒感染的肾脏、脾脏和回盲部瓣膜梗塞病变有关。此外,对哨兵猪的病毒血症和中和抗体水平的筛查显示,哨兵猪在攻毒后和整个实验期间与免疫猪瘟E2疫苗的猪同居期间没有发生猪瘟病毒的水平感染。这些结果表明,猪瘟E2亚单位疫苗的保护效力可以完全阻止病毒在免疫-攻毒-同居猪中的传播。
为实现地方性猪场根除猪瘟的目标,合理连续的疫苗免疫程序应包括安全有效的疫苗和母猪、仔猪及生长至育肥猪的灵活的免疫免疫程序,以及良好的生物安全控制措施。在试验II中,将猪瘟E2亚单位疫苗应用于猪场的怀孕母猪,获得了高安全性和良好的效力。母猪在分娩前3周和5周进行猪瘟E2亚单位疫苗免疫,其抗体水平高于配种前免疫猪瘟弱毒疫苗的母猪(图3)。
此外,根据唾液中猪瘟RNA的筛选,猪瘟E2亚单位疫苗免疫母猪显著降低了病毒 RNA的比例,而用弱毒疫苗免疫的母猪显示病毒RNA的比例非常高。由于母猪在保育阶段与胎儿密切接触,因此减少母猪的病毒分泌可以最大限度地降低垂直和水平传播给仔猪的风险。在之前的一项研究中,在妊娠中期(妊娠55天)用猪瘟弱毒疫苗免疫猪瘟抗体阴性母猪,其仔猪的存活率仅为 34.9%。虽然尸检没有发现病理变化,但在免疫疫苗的母猪及其仔猪的器官中检测到了猪瘟病毒RNA。
由于猪瘟E2亚单位疫苗抗原基于非感染性重组蛋白,因此可用于妊娠的任何阶段,以引发更高、更一致的免疫反应。换言之,分娩前抗体水平较高的母猪可能会为后代提供更充分的被动免疫以抵抗感染。在试验II中,相比免疫弱毒疫苗母猪后代,免疫猪瘟E2亚单位疫苗母猪的后代表现出明显高且持久的母源抗体水平。较高的母源抗体对于保护仔猪在初次免疫前免受可能的早期感染至关重要。然而,已经证明免疫期间的高母源抗体会损害弱毒疫苗的效力,因此,应根据母源抗体下降情况谨慎评估仔猪的疫苗免疫程序。出于安全考虑,只有在配种前在母猪身上免疫猪瘟弱毒疫苗才可以避免垂直传播。因此,经产母猪或后备母猪的抗体水平存在个体间差异。换句话说,来自不同经产母猪或后备母猪的每批仔猪在产房至断奶阶段会表现出更多的被动性获得抗体水平的差异,这将导致很难在一个猪瘟呈地方性流行的猪场为仔猪制定精准的首次免疫时间。
在试验II中,母源抗体水平概况表明,用猪瘟-E2亚单位疫苗免疫的母猪可以为12周龄的仔猪提供一致且足够好的被动免疫,而来自LPC疫苗免疫母猪的仔猪的被动免疫力不足,并在4到8周龄之间迅速下降。猪瘟E2亚单位疫苗(区别于LPC疫苗)的独特优势允许免疫的怀孕母猪给仔猪转移足够的被动免疫直至12周龄。这提供了在关键的4到8周内避免猪瘟初次免疫的益处的证据,这也是猪场中PRRSV、PCV2或细菌病原体并发感染的高峰爆发期。断奶后延期进行猪瘟免疫可以减少许多应激因素和母源抗体干扰,避免并发感染的干扰可能会为免疫疫苗的猪提供更全面和令人满意的体液免疫。
在试验II中,证明用猪瘟E2亚单位疫苗免疫的母猪通过显著减少病毒排泄并在断奶至保育阶段为其后代提供更一致和更持久的母源抗体来预防水平或垂直传播的风险。为了进一步评估母源抗体对猪瘟疫苗应用的干扰,设计了仔猪试验,用以比较在高水平母源抗体干扰下用猪瘟E2亚单位疫苗或弱毒猪瘟疫苗免疫仔猪所引发的体液免疫反应。由于LPC疫苗免疫母猪的后代母源抗体水平波动较大,平均低于猪瘟-E2亚单位疫苗免疫母猪的后代,因此猪瘟E2免疫母猪的仔猪具有高猪瘟特异性抗体阻断率(平均阻断率88.94% ± 0.94%,等同于中和抗体1:256或更高)且被挑选进行进一步评估。在试验III中,具有高母源抗体水平的仔猪在3和6周龄时用猪瘟E2亚单位疫苗或LPC疫苗进行免疫。在16周龄时加强免疫弱毒疫苗以模拟野外轻度至中度猪瘟病毒感染,猪瘟E2亚单位疫苗免疫仔猪的抗体水平在20周龄时急剧上升,表明即使在早期免疫的高水平母源抗体压力下,猪瘟E2亚单位疫苗也能引发有效的记忆免疫反应(图4)。所有猪瘟E2亚单位疫苗免疫的猪在整个试验期到上市销售期间都显示出足够的保护性免疫。相比之下,更多样化且六分之一的LPC疫苗免疫仔猪在加强免疫后表现出极低的抗体反应(阻断率6.15%),这表明即使对猪进行了两针弱毒疫苗的免疫,母源抗体也会干扰弱毒疫苗。抗体水平低下的猪可能成为猪瘟防控的缺陷,对猪瘟呈地方性流行的猪场而言是个免疫漏洞。
猪瘟弱毒疫苗的优势之一是早在免疫后5天就具有可能保护免疫猪只免受猪瘟病毒感染的能力,因此,人们认为猪瘟弱毒疫苗适用于暴发猪群的紧急疫苗免疫。自2018年9月以来,日本在野猪种群中使用弱毒疫苗(GPE株)进行口服免疫,以控制国内猪场再次爆发的猪瘟。然而,根据2019年3月家养猪场和野猪种群的监测显示,在附近地区检测到大量猪瘟病毒阳性动物。但是,仍然难以区分免疫过疫苗的猪和感染野毒的猪只,故在免疫弱毒疫苗后应进行长时间的监测。猪瘟E2亚单位疫苗安全性高,可防止病毒传播,不受母源抗体的干扰,因此在试验IV中采用猪瘟E2亚单位疫苗和猪瘟弱毒疫苗(LPC疫苗)的组合。猪瘟E2亚单位疫苗免疫母猪母源抗体水平较高的仔猪,一组在3周龄免疫猪瘟E2亚单位疫苗,一组在12周龄和16周龄免疫LPC疫苗,以减少母源抗体干扰以及评估不同疫苗免疫程序诱导的免疫反应。所有猪瘟E2亚单位疫苗免疫的仔猪在断奶至育成阶段都具有高且足够的猪瘟特异性抗体水平,这表明疫苗具有足够的保护效力。尽管LPC疫苗免疫的仔猪在4至20周龄时具有足够的平均抗体水平,但十分之二的猪在12和16周龄时抗体水平不足(图5)。该结果表明在母猪中使用猪瘟E2亚单位疫苗以获得一致和持久的母源抗体的前景,并提示了在12周龄后用弱毒猪瘟疫苗对仔猪进行延迟首次免疫的策略。在母猪和仔猪中使用猪瘟E2亚单位疫苗,或在母猪中使用猪瘟E2亚单位疫苗,然后在仔猪日龄较大时候使用猪瘟减毒活疫苗的组合,为猪场设计预防猪瘟的疫苗免疫程序提供了更大的灵活性。此外,在配种前3周和5周免疫猪瘟E2亚单位疫苗的母猪唾液中猪瘟RNA检测率显著低于长期配种前免疫猪瘟弱毒疫苗的母猪。试验结果表明,猪瘟E2亚单位疫苗免疫具有更低的水平或垂直传播风险,是另一种在猪瘟再次爆发和重新免疫期间进行有效监测的工具。
结论
在本研究中,进行了几项动物试验,包括SPF猪模型、母源抗体干扰分析和免疫组合策略,以评估猪瘟E2亚单位疫苗在猪场应用中的临床效力。该试验结果证明猪瘟E2亚单位疫苗能够克服猪瘟弱毒疫苗的主要缺陷,能提高疫苗免疫效力来更好地净化猪瘟,也为猪瘟E2亚单位疫苗的使用提供了有价值的指导。

徐晓杰
天康制药技术服务经理
南京农业大学预防兽医学硕士,执业兽医师。先后在江苏温氏、江苏华丽等公司从事猪群健康管理、疾病防控以及猪场规划。