
一、研究背景
我国是生猪养殖和猪肉消费第一大国,每年消费近7亿头猪,相当于每2人一年要吃掉1头猪。猪肉是我国的主要肉食来源,约占肉类消费的60%。且生猪产值超过1万亿元,占整个农业板块的比重非常高。因此,生猪产业是我国重大的战略性基础产业。然而,我国虽然是养猪大国,但不是养猪强国,与欧美发达国家相比还有很大的差距。
由于我国日益复杂的养殖环境,疫病已成为严重制约生猪产业健康发展的重要因素。特别是病毒性疾病,如猪蓝耳病和非洲猪瘟,一旦爆发,损失极其惨重。针对病毒性疾病的防控,一是从病毒角度出发(兽医方向)(如图1所示),聚焦病毒,研发疫苗和抗病毒药物,但是病毒变异非常快,特别是RNA病毒,对变异毒株疫苗交叉保护力弱或无,疫苗研发的速度永远赶不上病毒变异的速度;二是从宿主(猪)遗传角度出发(育种方向),发掘宿主抗性基因/易感基因,培育抗病猪,从遗传本质上提高宿主对疾病的抗病力,从宿主角度有望从根本上解决病毒性疾病的防控及其对养猪业的经济损失。
图1 病毒性疾病防控方案
在临床中发现,不同品种猪,甚至同一品种不同个体之间,对不同疾病表现出不同的抵抗力,提示疾病的感染和发生可能受宿主遗传因素的调节和控制。因此,可借助CRISPR/Cas9基因编辑技术、CRISPR全基因组敲除文库技术,以及全基因组关联分析,发掘重要的宿主抗性基因/易感基因(如病毒受体),研究病原致病机理与病原宿主互作机制,从遗传水平提高猪群对疾病的抵抗力,对生猪健康养殖和可持续发展具有重要的科学意义。
如何从猪个体自身抗病力的遗传潜力出发,发掘抗性基因/易感基因,提高猪群对一些特定重要疫病(如猪蓝耳病、猪流行性腹泻、传染性胃肠炎)的抗病能力,是未来动物疫病防控的重要方向,也为大幅度减少生猪养殖过程中疫苗和药物的使用提供科学依据。更重要的是:该方案符合国家饲料和生猪养殖减抗替抗的大方向,也有助于食品安全和环境保护。因此,通过遗传改良结合最新育种技术培育抗病猪新品种(系)是控制疫病发生与流行的最主要和根本方法。
二、我国猪抗病育种研究进展
目前,我国猪抗病育种领域,主要在猪蓝耳病、猪瘟、猪传染性胃肠炎、猪乙型脑炎、大肠杆菌方面做了大量的工作。
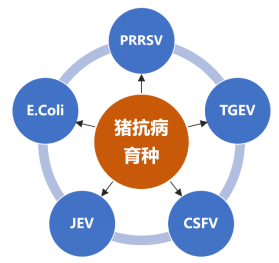
图2 猪抗病育种研究领域
1. 猪蓝耳病(PRRS)抗病育种
PRRSV主要侵染免疫细胞,破坏免疫系统,引起免疫抑制,号称猪的艾滋病。基于PRRSV以上特性,很难开发出安全有效的疫苗。目前从病毒角度研发的疫苗不但防控效果不理想,而且病毒血症时间长、引起免疫抑制、毒力返强致病、易与田间毒株重组。因此,亟需从宿主角度发掘抗性基因,培育抗病猪新品系,从根源上防控PRRSV。CD163是PRRSV入侵的必需受体,因此靶向CD163可有效防控PRRSV感染。2015年,美国密苏里大学联合堪萨斯州立大学和Genus公司,培育出世界首例CD163敲除猪,并证明该基因编辑猪完全抵抗PRRSV感染。相关成果发表于国际顶级期刊Nature Biotechnology上。抗猪蓝耳病CD163基因编辑猪奠基人为美国密苏里大学Randall Prather教授和美国堪萨斯州立大学Raymond R R Rowland教授(现为伊利诺伊大学香槟分校教授)。
由于CD163是肺泡巨噬细胞表面的特异marker,属于清道夫受体,具有重要的生物学功能,对清除外来入侵的病原体和血液中游离的血红蛋白具有重要作用。因此,CD163敲除会使其功能丧失。对此,2017年,英国爱丁堡大学培育出CD163受体SRCR5结构域缺失的基因编辑猪,且证明该基因编辑猪也能完全抵抗PRRSV感染。进一步证明了只删除CD163基因中的SRCR5结构域也能抵抗PRRSV,该基因编辑猪较CD163整个基因敲除编辑猪最大的亮点为保存了CD163的生物学功能。进一步地,本人所在团队培育出CD163受体SRCR5结构域中的LBP缺失基因编辑猪,同样证明该编辑猪能够完全抵抗PRRSV感染。进一步缩短了CD163基因的删除片段,从而最大限度地保留其生物学功能,相当于对CD163基因做了最小的手术,具有重要的产业化应用前景。
2. 猪传染性胃肠炎(TGE)抗病育种
除了猪蓝耳病,猪病毒性腹泻对养猪业的危害也非常大。病毒性腹泻主要感染7日龄以内的仔猪,因此死亡率特别高。2020年,中国农科院深圳农业基因组研究所李奎教授团队培育出CD163和pAPN双基因敲除基因编辑猪,并证明该基因编辑猪能够抵抗PRRSV和TGEV的感染,同时对猪德尔塔冠状病毒表现出下降的敏感性。另外,相较于野生型猪,CD163和pAPN双基因敲除基因编辑猪在产肉量、繁殖性状方面无差别,但是在双基因敲除编辑猪的肌肉里面铁含量更高。
3. 猪瘟(CSF)抗病育种
由于猪瘟疫苗免疫效果好,目前猪瘟在猪场的危害有限,可以开始做猪瘟净化了。大数据分析,目前全国CSFV的检出率低于5%。2018年,吉林大学欧阳红生教授团队利用RNA干扰技术结合CRISPR/Cas9培育出抗CSFV的转基因猪。需要注意的是,该转基因猪只能够有效地限制CSFV复制,减少CSFV相关的临床症状和致死率,这种抑制性能够稳定传到F1代转基因猪。但是,该转基因猪不能完全抵抗CSFV感染复制,只能抑制\减少,与前面的CD163基因编辑猪抵抗PRRSV感染有本质的区别。
4. 猪乙型脑炎(JE)抗病育种
乙脑是由乙脑病毒(JEV)引起的一种猪的病毒性传染疾病,夏季高发,主要通过蚊虫叮咬传播。目前临床上乙脑感染的病例较少见,主要通过疫苗免疫预防。2020年,华中农业大学赵书红教授团队利用CRISPR全基因敲除文库技术,筛选鉴定JEV入侵靶细胞依赖的宿主因子(宿主易感基因)。他们鉴定出大量未被报道的在JEV入侵过程中发挥重要作用的宿主蛋白,包括EMC3和CALR基因。另外鉴定出4个与硫酸乙酰肝素蛋白多糖代谢相关的宿主因子,这些蛋白促进JEV的入侵。以上研究为JEV抗病育种奠定基础。
5. 猪大肠杆菌(E.Coli)抗病育种
7日龄以内仔猪,特别是新生仔猪,容易发生腹泻,且一旦腹泻极易导致脱水消瘦而死亡。因此,腹泻是导致新生仔猪死亡的主要原因。产肠毒素大肠杆菌(EnterotoxigenicEscherichia coli ETEC)是引发新生仔猪腹泻的主要病原之一。据报道,至少1/3的断奶前仔猪腹泻是由ETEC F4引起。如何从根源上防控仔猪腹泻是当前养猪业面临的问题。江西农业大学黄路生院士团队借助全基因组连锁定位分析、目的区域重组断点事件分析和远缘群体高通量SNP标记的关联分析等技术,筛选鉴定到MUC13基因是决定仔猪ETEC F4ac腹泻抗性/易感性的关键基因(图5)。更重要的是,发现了能够准确鉴定抗性/易感个体的关键分子标记。该研究为筛选抗腹泻病新品种(系)猪奠定了坚实的基础,为实现我国种猪遗传改良的创新储备了自主知识产权。
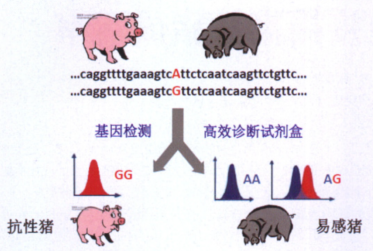
图5 ETEC F4ac仔猪腹泻抗病基因育种技术示意图(引自《猪业科学》2012年第1期)
三、未来发展趋势
疾病是影响生猪产业健康发展的主要因素,对养猪业造成巨大的经济损失。且大量的疫苗和药物的使用、滥用对食品安全和环境保护构成巨大的隐患和威胁。另外,特别是免疫抑制性疾病,通过疫苗免疫不但不能防止该病的发生与流行,反而促使了病原的变异重组和加重了该病的防控难度,使防控变得更复杂和难上加难。因此,通过抗病育种的方式,发掘宿主抗性/易感基因,培育抗病猪新品种(系),可从根源上解决疫病的发生与流行,特别是针对疫苗效果不理想的重大动物疫病(如非洲猪瘟和猪蓝耳病)。且该方法无需接种疫苗和使用药物,有助于食品安全和环境保护,符合国家的方针政策。同时,疫苗和药物使用的减少,可显著降低猪的应激,降低养猪成本和用人成本,更加符合国际关注的动物福利法。更重要的是,从中央到地方特别重视种业振兴,打好种业翻身仗,解决种业卡脖子问题。通过抗病育种的方式培育抗病猪新品系,有助于我国种猪遗传改良的自主创新,符合国家未来的发展方向。
常规全基因组关联分析选育抗病猪的速度较慢,近些年猪抗病育种的迅猛发展要得益于CRISPR/Cas9基因编辑技术。特别是这几年发展起来的CRISPR猪全基因组敲除\激活文库技术、CRISPR猪膜蛋白敲除\激活文库技术,大大地促进了抗性/易感基因的发掘,有力地促进了猪抗病育种的发展。进行抗病育种的第一步是要发掘宿主抗性/易感基因,特别是病毒的受体。因为病毒入侵的第一步必须与宿主表面的受体结合,因此,筛选鉴定病毒的受体对病毒的防控至关重要。如目前已知的PRRSV受体CD163,可作为基因编辑的重要靶点。目前ASFV的受体未知,这也是ASFV成为养猪业头号杀手的关键原因。借助CRISPR猪膜蛋白敲除\激活文库技术若可鉴定到ASFV的关键受体,对ASFV抗病育种及防控至关重要。
在利用CRISPR/Cas9进行抗病育种研究时,针对某些具有重要生理功能的基因,若敲除整个基因,可能对机体有重要影响(如PRRSV受体CD163基因)。因此,为了最大限度地保留其生物学功能,需精准编辑,特异删除该基因中与病毒刺突蛋白或糖蛋白互作的关键结构域或关键氨基酸。甚至利用单碱基编辑技术,只删除或突变某几个或某一个氨基酸,达到抗病的目的,培育单碱基编辑猪。这种方式培育的抗病猪既能抗病又能基本完全保留其生物学功能,因此产业化应用潜力巨大。
CRISPR/Cas9基因编辑技术是21世纪生命科学领域的一项重大革命性突破,在加速种质资源创新和新品种培育方面发挥了巨大的作用。目前,在我国,基因编辑技术在动植物中仅限于科研,不能用于应用。基因编辑属于转基因范畴,公众对转基因食品特别敏感,其安全性有待进一步研究。令人兴奋的是,2023年4月28日,从农业农村部官网获悉,中国第一个应用于大豆的基因编辑生物安全证书落地,有效期5年,预示着基因编辑育种迈出了关键的一步。2023年5月1日华盛顿州立大学网站报道,该大学日前获得了美国食品药物监督管理局(FDA)的授权,可以让基因编辑猪进入食物链供人类消费。具体产品是利用基因编辑猪肉制成的美味德式香肠,这将创造基因编辑动物的人类食用历史。2023年5月3日,加拿大农业和农产品部长Marie-Claude Bibeau表示,加拿大食品检验局 (CFIA) 将着手更新该国种子法规第V部分的指南。根据自2021年以来一直在协商的这些变化,基因编辑的植物材料将不会被归类为转基因。综上,相信在不久的将来基因编辑猪育种可能落地,运用于生产实践。
最新发布