
国内猪病实验室从2010年的“懵懂”,2015年前后的“发展”,到2018年后非瘟时代的“普及”,给我国猪病诊断带来了巨大帮助。后非瘟时代临床及实验室的打通已然是新一代猪兽医的必备技能。
在临床实践的不断摸索过程中,不管是后备猪的更新入群、放养母猪及仔猪猪群流转及保健方案、暴发后的控制与净化、双阴群体的维持,都离不开实验室检测。从样品类型上(组织-血液-精液-唾液-脐带血-睾丸液-乳房擦拭液-死猪舌尖液-扁桃体拭子等等)、检测数量上以及检测频率等各个方面,在借鉴国外同行的基础上我们也一直在不断更新、优化与进步,而如何利用实验室这一工具真正辅助生产中蓝耳病的防控与净化工作,是每个猪兽医需要长期跟踪、不断思考、持续优化、归纳总结的重要课题。
在社会化服务的过程中,笔者遇到很多“形形色色、奇奇怪怪”,“看似专业又似是而非”的问题,两年前整理过蓝耳病抗原检测的几个常见问题(Swine Vet Share | 张振东:猪蓝耳病抗原检测的常见疑惑),现梳理近期遇到的常见误区或疑惑,分享给同行参考。

常见误区与疑惑:
1) 过度追求qPCR检测试剂敏感性,唯CT值论
CT值(Cycle Threshold)即循环数阈值。CT值越小说明循环次数越少,CT值20表示样品中的核酸放大2的20次方(1048576)倍可以检测到阳性,CT值36表示放大2的36次方(68719476736)倍才能检测到阳性,说明要更多时间与循环,需要放大很多很多倍才能检测到,代表病毒含量相对较少。
CT值结果受太多因素影响,尤其病毒载量较低时候,而正因为如此,低病毒载量能否检出CT值作为了许多同行实验室评比诊断试剂优劣、大做文章的切入点,不理智的市场需求导向,便会导致甚至倒逼试剂供应商为了迎合需求而出现过度内卷的现象,更有兽医人员吐槽在于经营管理者沟通专业问题时,那更是秀才遇上兵,只能叹气一声,听你的。
大家可再想一想新冠COVID-19的诊断标准及CT值判断解读,难不成猪病比人的疾病更为复杂?
我的观点:
多数qPCR诊断试剂敏感性都是可接受的,优选标准应是稳定性大于敏感性,尤其在当前自配大环境下,稳定性更为重要;
猪群持续跟踪监测的意义要大于试剂的敏感性;
猪群采样评估检测/监测方案的意义要大于试剂的敏感性;
在净化或双阴群体可适当提高检测标准但结果要合理解读;
在净化或双阴群体检测频率的意义要大于试剂的敏感性;
试剂供应商系统服务能力的意义要大于其诊断产品的敏感性。
总之,有太多事情比敏感性重要,不能拿敏感性过度讲故事,如若这样喧宾夺主,难免得不偿失、越搞越复杂!
2)检测到阳性,就是蓝耳病暴发?

在过度内卷敏感性的时候,当一个猪群中一直稳定,但突然出现个别样品CT值37时,如何解读?红绿灯如何显示?
当突然较高比例检出或者偶有样品检出且CT值较低时,是蓝耳病暴发了吗?检测异常并不等于临床异常,也不等于暴发。了解蓝耳病毒的排毒规律,清楚自己的对手和自己的团队作战能力,这是专业且敢担当优秀猪兽医的价值所在。
此外,笔者建议猪兽医同行甚至经营管理可参照AASV蓝耳病划分等级的标准,有了标准就好对标,就有了共同语言,不然就是各说各话;建议经营管理者更要相信猪兽医同事尤其兽医总监的专业度,过度干预专业工作,往往劳民伤财,内耗严重,适得其反。
3)病原检测为阴性,万无一失?
目前依然有很多同行疑惑引种后备qPCR核酸检测全是阴性,抗体阳性,入群后为什么出现波动?不是阴性吗?不是有抗体保护吗?
可参照先前发布分享的文章进行了解,不过多赘述。
经典文献 | PRRSV母猪间的传播实验:血液或唾液检测阴性混群后一定稳定?
54th AASV | 检测阴性并非真阴性,样品质控很重要
54th AASV | 棉绳采样:妊娠大栏孕猪咬绳效率调查
附PRRSV排毒时间作参考:

4)为了双阴而双阴,为了净化而净化
张振东:蓝耳病净化内卷?不盲目追求,先做自己能做好的事!

5)临床怀疑PRRSV,但检测为阴性
除了本身带毒情况外,影响检测结果的最主要因素为样品类型和检测方法。长距离运输尤其炎热季节导致的核酸降解会影响检测结果;反复冻融样品会影响检测结果;长期添加抗病毒药物可能会影响病原检出;公猪精液细胞的检出率要大于精液上清;每窝流产胎儿要取3个(至少2个)以上混样检测(取脐带与胎盘连接处方便或取舌尖液混样检测);低流行率下,每窝采集2-3头弱仔猪血样检出率要大于每窝只采1头;有文献讲到家族口腔液4℃解冻比室温解冻,CT值要低(未验证);普通RT-PCR方法,要确定检测哪个片段,一般情况下,检出率ORF7>ORF5>nsp2,建议可多个片段同时检测同时测序;警惕并加强PRRSV 1(欧洲型)的检测。对于PRRSV的诊断需要多方面的客观综合分析,绝不能盲目依赖PCR结果,拒绝PCR“傻瓜式”兽医。

6) 检测就是疫苗毒,疫苗毒致病?
检测时机、测序区域、测序深度及宽度分析对于理解该问题非常重要。对于商品猪在免疫后的一定时间内检出疫苗毒株是正常现象;产房仔猪免疫弱毒疫苗(毒力特别弱的)会因母抗的存在检测阴性,但断奶后叠加应激因素会检测到阳性;在PRRSV暴发后采用闭群+群体免疫疫苗驯化+净化策略防控的猪场,2-3个月内检测出疫苗毒也是正常现象;对于实施疫苗阳性稳定策略的猪场,检测出疫苗毒也要客观综合分析。而这其中判定为疫苗毒的标准是什么?一般情况下,临床上只检测一个片段,比如ORF5检测分析为疫苗毒株,场内是否存在其它毒株?是否要检测其它区域?是否为重组毒株?净化过程中出现波动甚至失败,是死灰复燃(没压下去)还是重组出新毒株需要系统分析。对于苗猪,检测阳性的不一定难养,阴性的也不一定好养。疫苗毒的存在对本场是利是弊需要客观分析,降低猪群PRRSV的丰富度(中国动物检疫 | PRRSV-ORF5 PCR扩增产物的多样性分析),避免“新毒株”(与本场毒株不同就是新毒株)的进入和出现(重组)是降低PRRSV暴发风险的关键。
可参看如下数据,美国猪场测到的PRRSV序列多为疫苗来源(vaccine-like)
7) PRRSV毒株傻傻分不清?
经典、高致病性、NADC30/34、谱系、RFLP 1-4-4傻傻分不清。在我国,“经典”主要指1996-2006年期间流行于国内的毒株,以及包括由经典毒株为亲本的疫苗毒株,分子特征上无任何缺失;“高致病性”指2006年暴发的以nsp2基因上30个氨基酸缺失为分子特征的株;“NADC30、NADC34”均是分离自美国的毒株,其nsp2基因上分别缺失131、100个氨基酸,由于近年来国内分离到与其相似缺失模式的毒株,因此称为类NADC30、类NADC34(本实验室检测了大量ORF5序列,进化树分析与NADC34较近,但其nsp2区域并不是100个氨基酸的缺失,而这跟最初NADC34的标记缺失并不一致,因此是否为类NADC34毒株建议要对nsp2区域进行检测分析)。谱系是基于ORF5基因的遗传进化分析,RFLP是基于ORF5基因的多态性分析,比如,某毒株X属于谱系8,其RFLP模式为1-7-4。当前我国PRRSV毒株重组现象频繁,进行全基因测序基本找不到未发生重组的单一序列,“盲人摸象”似的病毒分类需要优化调整。
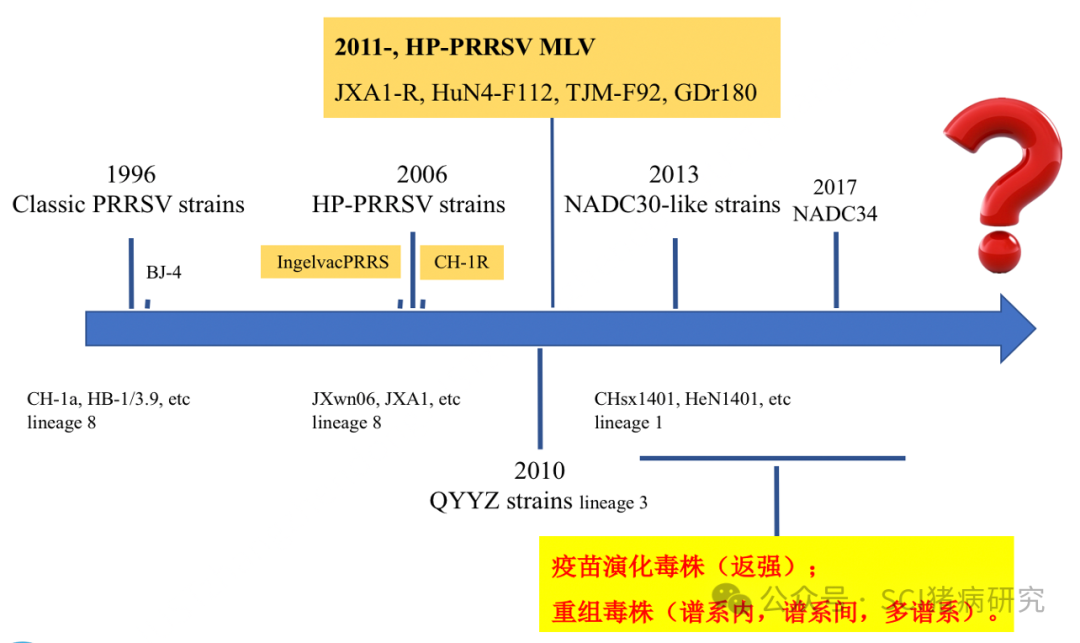
8) 通过测序比对同源性筛选疫苗毒株?
一般来讲,同源性越高保护性越好。但对于当前我国PRRSV流行毒株来讲,并不需要基于ORF5基因或其它部分序列同源性的高低,去作为筛选MLV的标准,数据依据可参照下图。

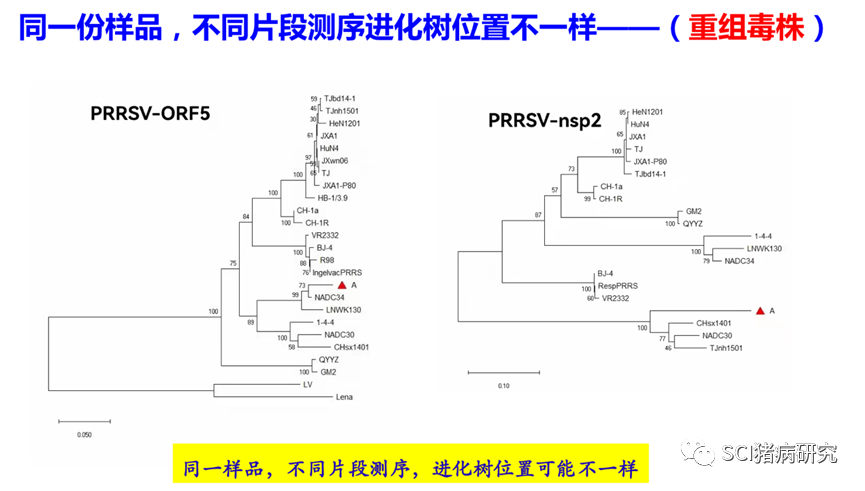
9) 测序结果不一致。
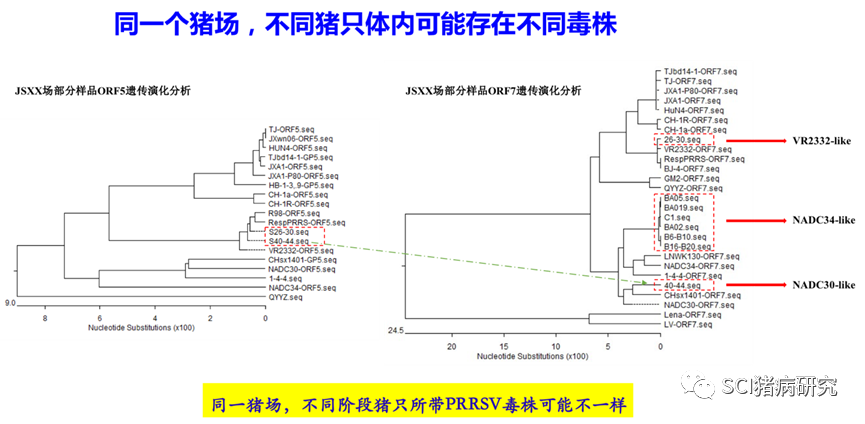
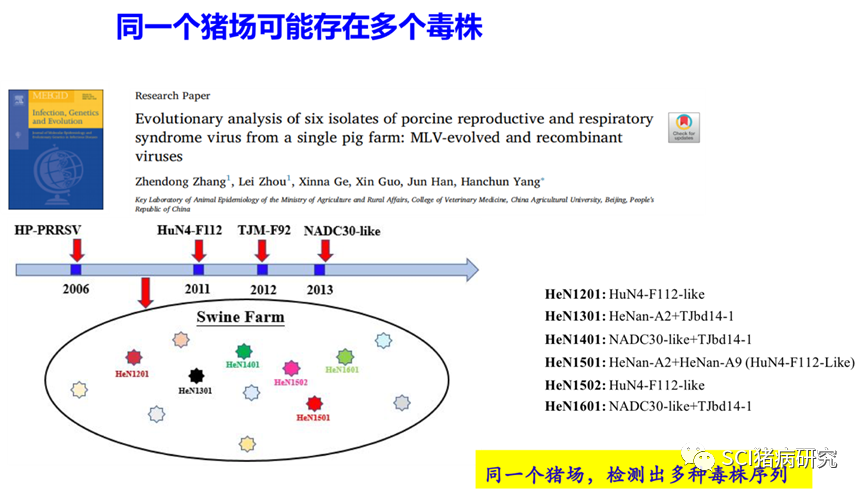
对PRRSV部分片段测序后进行遗传演化进化分析,同一份样品中检测分析PRRSV的不同片段,进化树上属于不同分支(比如ORF5属于谱系1,而nsp2区域与谱系8毒株处于一个分支),这多半是因为存在重组现象;同一头猪只体内,检测到的PRRSV不一样;同一个猪场,同阶段或者不同阶段猪只检测到的PRRSV不一样;同一个猪场/养殖体系检测到不同的PRRSV毒株等以上几种均属正常现象。送到不同测序委托单位测序结果不一样,跟其测序分析的片段直接相关,分析的片段不一样,恰巧是重组毒株,那自然不一样。此外,qPCR扩增的阳性产物序列太短,一般不用于测序分析。
最新发布