
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)又称为猪蓝耳病,是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种高度传染性疾病,对所有年龄段和所有品种的猪易感。病毒感染可引起母猪乏情、返情、屡配不孕等现象;妊娠母猪流产、早产、产死胎和木乃伊化比例增加;仔猪和育肥猪出现严重的呼吸道症状;公猪性欲减退、精液质量降低等症状。自1987年PRRS在美国中西部发现以来,迅速传播到西欧和东南亚,给各国生猪养殖造成了巨大的经济损失和生产挑战。据报道,美国养猪业每年的经济损失高达6.64亿美元。猪圆环病毒2型(Porcine circovirus type 2,PCV2)是引起母猪繁殖障碍、断奶仔猪多系统衰竭综合征、皮炎和肾病综合征的重要病原体,同时也被认为是对当前全球养猪业影响最深远且最普遍的病原体。PCV2侵入猪体后,主要存在猪的腹股沟淋巴结、扁桃体、胸腺等免疫器官中,致使宿主产生严重的免疫抑制效应。此外,该病还可导致感染猪群发生持续性感染,使得疫病长期存在,难以根除,是困扰养猪业发展的一大难题。
河北省作为我国的养猪大省之一,规模化猪场众多。2024年9月,河北省某猪场发生疫病,临床症状表现为妊娠母猪流产、产死胎,患病仔猪出现严重的呼吸道症状,甚至死亡。对死亡仔猪进行病理剖检,病变可见肺脏出血,淋巴结肿大。根据临床症状及病理剖检结果初步怀疑存在PRRSV和PCV2混合感染。本研究先利用荧光定量PCR技术对可能病原进行检测,随后对检测为阳性的样本进行序列测定,再将获得的序列进行分析,以明确该猪场的感染情况和病原特征,为更加精准制定有效的防控措施提供依据。
1 材料与方法
1.1 材料
1.1.1 病料来源
本研究临床样品来自河北省某规模化猪场。2024年9月该猪场出现了妊娠母猪流产、产死胎等生殖障碍问题,仔猪出现严重的呼吸道症状,严重者发生死亡。
1.1.2 主要试剂
DL 2000 DNA Marker,pMD™19-T载体,西班牙琼脂糖购自宝日医生物技术(北京)有限公司;病毒DNA/RNA提取纯化试剂盒、猪繁殖与呼吸综合征病毒(通用)实时荧光RT-PCR检测试剂盒、猪圆环病毒2型实时荧光PCR检测试剂盒购自湖南冠牧生物科技有限公司;大肠杆菌DH5α感受态细胞、氨苄青霉素钠、X-gal溶液、IPTG购自北京索莱宝科技有限公司;BioRT Master逆转录扩增(一步法)试剂盒(含染料)购自杭州博日科技股份有限公司;质粒小量提取试剂盒购自杭州倍沃医学科技有限公司。
1.2 方法
1.2.1 样品处理
将待检组织样品与生理盐水按照1:3进行稀释研磨,-20℃反复冻融3次后,12 000 r/min离心10 min后取上清液,经0.22 μm滤膜过滤除菌,置于-80℃保存备用。
1.2.2 病毒核酸提取与病原检测
取200 μL研磨的组织上清液,按照病毒DNA/RNA提取纯化试剂盒对病毒RNA和DNA进行提取,随后利用猪繁殖与呼吸综合征病毒(通用)、猪圆环病毒2型、猪瘟病毒实时荧光定量PCR检测试剂盒对送检样品进行荧光定量PCR检测。同时将剩余DNA/RNA置于-80℃保存备用。
1.2.3 PRRSV ORF5、PCV2 ORF2序列扩增
对鉴定PRRSV和PCV2均为阳性的样品分别进行PRRSV ORF5序列和PCV2 ORF2序列扩增,扩增引物由笔者实验室保存。PRRSV ORF5序列扩增以提取的病毒RNA为模板,PCV2 ORF2序列扩增以提取的病毒DNA为模板,反应体系和反应程序按照试剂盒说明书进行操作。PCR反应结束后,取10 μL PCR扩增产物经1.5%琼脂糖凝胶进行电泳检测,并在凝胶成像系统拍照观察。
1.2.4 克隆与测序
将扩增的阳性PCR产物经纯化后与pMD™19-T载体连接,转化至大肠杆菌DH5α感受态细胞中,涂布至含终浓度为100 μg/mL氨苄青霉素钠、0.1 mg/mL X-gal溶液、0.75 mg/mL IPTG溶液的LB固体培养基,37℃培养箱培养12~16 h后,挑取单个白色菌落接种至含终浓度为100 μg/mL氨苄青霉素钠的LB液体培养基,37℃ 200 r/min摇菌培养12~16 h后,利用质粒小量提取试剂盒提取质粒DNA,将提取的质粒DNA送至生工生物工程(上海)有限公司进行序列测定。
1.2.5 基因组序列分析
选取NCBI已发布的国内外代表性的PRRSV ORF5和PCV2 ORF2序列作参考(表1),利用DNAStar的MegAlign程序和MEGA 10.0软件对测序正确的PRRSV ORF5序列和PCV2 ORF2序列进行核苷酸同源性比对并构建系统发育进化树。

2 结果
2.1 病原检测结果
经荧光定量PCR鉴定,显示该猪场存在PRRSV和PCV2混合感染,Ct值见表1。
2.2 基因组序列分析
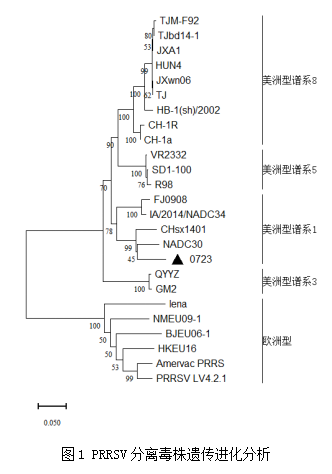
选择PRRSV和PCV2荧光定量检测结果均为阳性且Ct值较低的样品利用笔者实验室引物进行PRRSV ORF5和PCV2 ORF2序列扩增,将扩增的样本连接至pMD™19-T载体后进行序列测定。本研究分析样品标记为0723。将获得的PRRSV ORF5序列与从GenBank中下载的ORF5参考序列通过DNAStar MegAlign的Clustal W方法进行同源性比对,结果显示核苷酸同源性为57.8%~91.4%,与NADC30毒株同源性最高,为91.4%。氨基酸同源性在51.5%~91.7%,与NADC30毒株同源性最高,为91.7%。遗传进化分析结果显示,0723毒株属于美洲型谱系1,与NADC30毒株亲缘关系最近(图1)。
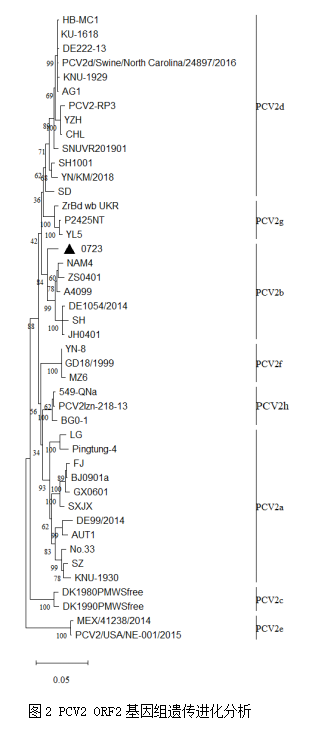
对PCV2 ORF2序列进行分析,结果显示,与参考毒株比对,核苷酸同源性为91.3%~98.4%,与A4099毒株同源性最高,为98.4%。氨基酸同源性在83.3%~97.1%,与A4099毒株同源性最高,为97.1%。遗传进化分析结果显示,0723毒株属于PCV2b亚型(图2)。
3 讨论
河北省在全国养猪产业中占有重要地位,拥有大量的养猪企业和专业化养殖模式,对该省重大猪疫病监测和预防对于整个养猪业具有重要意义。PRRSV和PCV2是引起母猪生殖障碍和仔猪呼吸道疾病的两种重要病原体,猪只同时感染PRRSV和PCV2两种病原体在临床较为常见。PRRSV属于动脉炎病毒科、动脉炎病毒属成员,是具有囊膜的单股正链RNA病毒,基因组全长约15 Kb,通过两种不同的转录机制表达一系列结构蛋白和非结构蛋白,编码至少10个开放阅读框,其中ORF5编码主要的膜蛋白,该区域高度可变,常作为PRRSV遗传进化分析的靶基因。自2006年,我国暴发高致病性PRRSV以来,由于其传播迅速、发病率和死亡率高等特点,给中国养猪业造成了巨大经济损失。2008年,高致病性猪蓝耳病被农业部归为一类疫病。由于PRRSV不同亚型之间基因组同源性较低,易发生突变和重组,导致新的毒株不断出现。2014年,我国首次报道NADC30毒株,该毒株基因组Nsp2区存在131个不连续氨基酸缺失,且该毒株致病性介于经典毒株与高致病性毒株之间。2018年,我国辽宁省首次检测到NADC34毒株,2020年以后,类NADC34毒株在我国多个省份流行。2011年,我国分离到了PRRSV欧洲株,随后欧洲株的检出数量逐渐增多,表明PRRSV欧洲株正在成为危害我国生猪健康的又一重要病原。据统计,目前我国PRRSV呈类NADC30毒株、类NADC34毒株、高致病性毒株、欧洲毒株共存的局面,给疫病的诊断和防控带来了极大的挑战。
PCV2为单链、环状DNA病毒,是已知感染哺乳动物的最小DNA病毒。PCV2基因组大小约为1.7 Kb,至少包含11个潜在的开放阅读框,其中,ORF2所编码的Cap蛋白存在多个抗原表位区,加快了PCV2的变异速度,所以,PCV2 ORF2区域通常被当作PCV2遗传变异分析的标记基因。根据系统发育分析分析,将PCV2划分为八种基因亚型(PCV2a至PCV2h)。自2000年PCV2首次在我国报道以来,在我国广泛流行,并且一直保持着快速进化的态势。当前我国PCV2的优势流行毒株为PCV2b和PCV2d亚型,同时PCV2常与其他病原体混合感染,如PRRSV、CSFV等,这使得疾病的诊断和防控变得更为复杂。
本研究对该规模化养猪场此次暴发的疫情做了诊断和分析,首先利用荧光定量PCR检测技术确定该场存在PRRSV和PCV2混合感染。随后,利用Sanger测序技术对该场感染的病毒进行序列测定,并利用生物信息学相关软件对其亚型进行分类。结果显示该场PRRSV疫情感染的是类NADC30毒株,PCV2感染的是PCV2d亚型,这与此前该地区流行毒株一致。由于这两种病毒均可破坏猪只免疫系统,导致猪只产生严重免疫缺陷,从而加重患病猪只的临床症状。虽然PRRSV和PCV2混合感染对养猪业造成了极大威胁,但通过综合治疗、科学管理和预防,仍可以有效控制疫情,减少经济损失。
最新发布