
猪繁殖与呼吸综合征(PRRS)又称猪蓝耳病,其荧光PCR(Q-PCR)检测是目前很多实验室常用的诊断方法。但在实际操作中,经常会遇到扩增曲线出现“翘尾”现象、有扩增曲线但无Ct值以及不知道如何选择全血、血清和血浆等问题,现分析如下。
1 荧光PCR的反应过程
1.1 荧光PCR反应过程的3个阶段
Q-PCR是在PCR反应体系中添加荧光报告基团和荧光淬灭基团,通过荧光信号来实现对核酸分子的定量检测过程,并通过制作的标准曲线对添加的原始模板进行相对定量的分析。整个反应过程大致可分为平台期、指数期和基线期3个阶段,见图1。
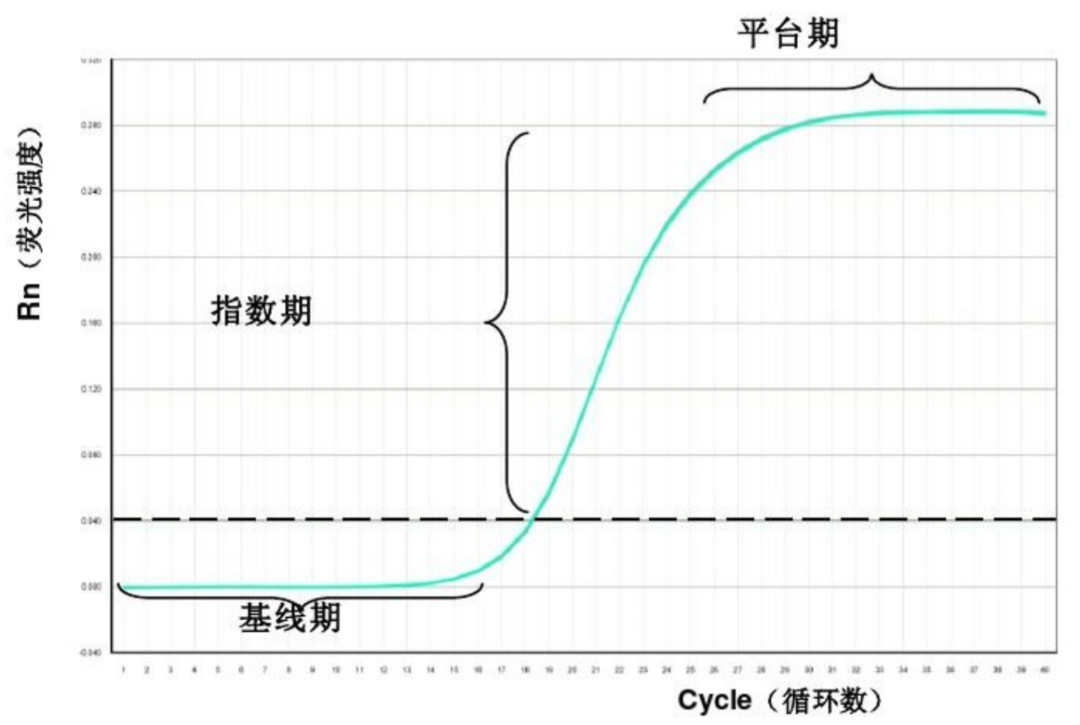
图1 Q-PCR反应过程的3个阶段
1.2 常用参数
为了便于定量分析,在qPCR反应中引入了荧光阈值和循环阈值(Ct值)两个概念。荧光阈值:是人为在荧光扩增曲线上设定的一个值。Ct值:是指在PCR反应过程中,每个反应管内的荧光信号达到设定阈值时所经历的循环次数。即起始模板浓度越大,其达到荧光阈值所需的循环数越小,则Ct值越小,反之,Ct值就越大。见图2。
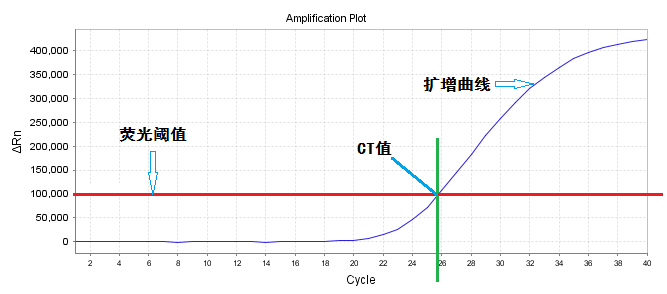
图2 Q-PCR的常用参数
2 检测过程中出现的常见问题与处理措施
2.1 Q-PCR扩增曲线出现“翘尾”现象
对于Q-PCR的结果判断,最直观的就是看扩增曲线的形态是否正常。在实际Q-PCR检测过程中,有的实验室经常会遇到各种离奇的扩增曲线,如何分析这些奇形怪状的扩增曲线并且做出有效的应对方案是一线检测员需要练就的基本功。如在检测PRRS的过程中,观察到Q-PCR扩增曲线在后期出现“翘尾”现象,即扩增曲线在达到平台期后继续上升,形成尾部上翘的形状,就是不少实验室检测人员经常遇到的问题。见图3。
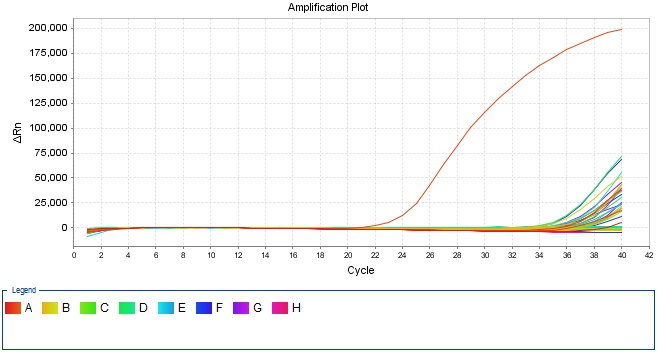
图3 Q-PCR扩增曲线出现中出现“翘尾”
2.2 常见原因分析与处理措施
(1)整板反应板都出现“翘尾”现象,很大概率是气溶胶污染。
(2)阴性对照出现“翘尾”现象,很大概率是阴性对照试剂污染。
(3)阴性对照正常,部分样品出现“翘尾”现象,可能是样本浓度低或者加样量不准确。排除污染原因后复测样本,如果复测结果为阴性,说明之前的“翘尾”现象为非特异性扩增,如果复测后扩增曲线仍存在“翘尾”现象,则说明该样本中待检猪繁殖与呼吸综合征病毒(PRRSV)核酸的浓度偏低。
2.3 Q-PCR有扩增曲线,但无Ct值
(1)没有设置正确的基线和阈值。基线和阈值是用于确定Ct值的重要参数,如果它们的设置不合理,就可能导致无法得到Ct值。比如基线设得过高或者阈值设得过低,软件可能无法正确识别荧光信号的变化来计算Ct值。可手动设置阈值线,在手动设置前的小方块处勾选即可,见图4。
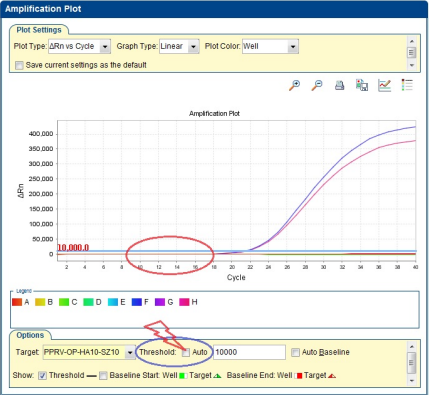
图4 Q-PCR 阈值线手动设置示意图
(2)样本浓度过低。尽管有正常的扩增曲线,但如果样本中的目标核酸太少,荧光信号强度可能一直达不到能被判定为Ct值的水平。
(3)仪器故障。比如检测荧光信号的部件出现问题,不能准确地捕捉和记录荧光信号,使得Ct值无法正常计算,不过这种情况比较少见,因为仪器通常会有内部的检测和报错机制。
3 如何选择血液样本?
在PRRSV的分子检测过程中,血液是采集较为方便且非常实用的样本。检测人员越来越意识到,正确选择血液样本是检测能否成功的重要因素。其中,对于血液样本可能会存在这样的疑问:全血、血清、血浆,哪一种样本更适合进行PRRSV的核酸检测?见图5。
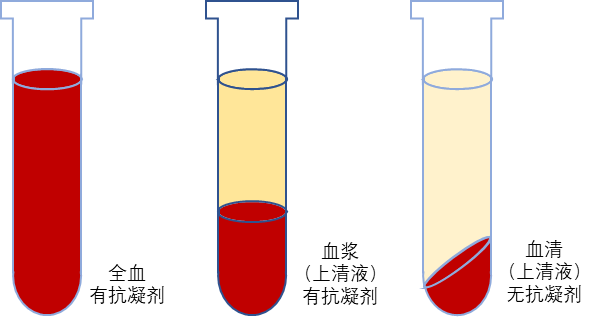
图5 全血、血浆和血清示意图
德国的Ahmed Elnagar研究员对PRRSV感染后不同时间点收集的EDTA血液、血清和血浆进行Q-PCR检测比较分析,结果显示:血浆样本具有更低的Ct值,即血浆更适合用于PRRSV的检测。因此对于PRRSV检测来说,为提高检测的敏感性,在进行血液样本选择时,使用血浆作为待测样本,可提高检测的灵敏度,提高检出率。同时,需要特别说明的是:在使用血浆样本进行Q-PCR检测时,需使用EDTA抗凝管,严禁使用肝素钠抗凝管。因为肝素钠是Taq酶的强抑制剂,且在核酸提取过程中很难将其全部去除,肝素钠抗凝剂会显著抑制PCR扩增,进而导致检测失败。
最新发布