背景
轮状病毒是引起新生儿和青年人及包括猪在内的多种动物腹泻的主要病原。轮状病毒于1969年首先发现于犊牛(Mebus等,1969),继而在人类(Bishop等,1973)、猪(Rodger等,1975)和其他动物中发现。基于VP6抗原性可将猪轮状病毒分成四个血清型(A,B,C,E)。血清A型轮状病毒是引起仔猪(包括断奶前后的)腹泻最常见的亚型,在由轮状病毒引起商品化猪群的所有腹泻病中占90%以上(Will等,1994)。
病因学
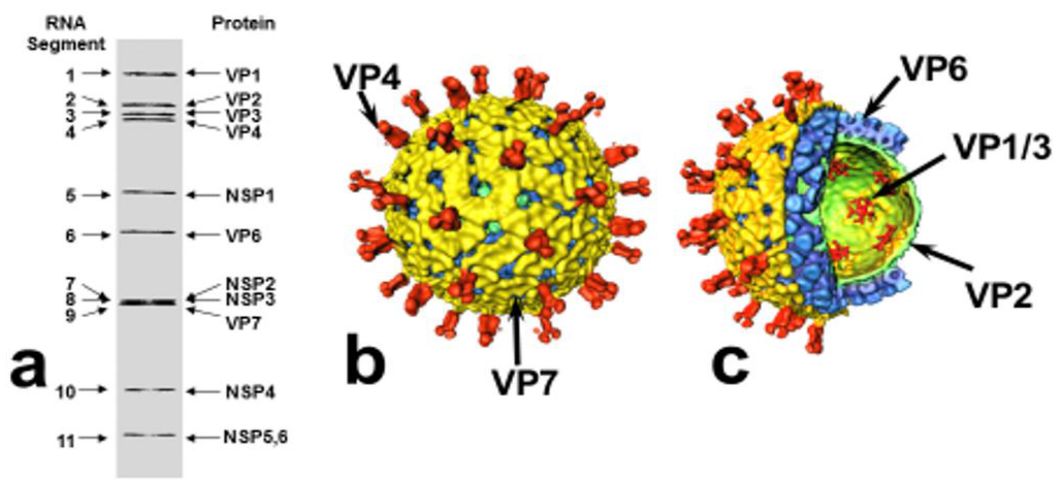
轮状病毒为无囊膜的二十面体粒子,直径65~75nm。轮状病毒全基因组长约18522bp,含11节段的双股RNA(Estes和Cohen,1989)。除了11节段编码NSP5和NSP6以外,每个基因节段编码6个结构蛋白和非结构蛋白其中的一个(Estes和Kapikian,2007)。VP6是数量最多的病毒结构蛋白,其次是糖蛋白VP7。VP4为非糖基化蛋白,被蛋白酶水解后,剪切成VP5和VP8,对病毒的传染性至关重要。
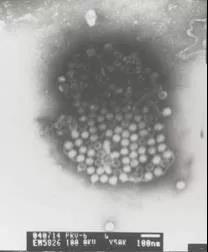
PoRV电镜负染照片
轮状病毒含有三层衣壳:外层由VP7和VP4组成;内层为VP6;核心由VP1、VP2和VP3组成。在电子显微镜下可以观察到,完整的三层粒子结构组装成一个轮状体(rota in Latin)。经过多种化学试剂和酶处理后,可以除去由VP7和VP4组成的外层衣壳。剩下的双层粒子结构的直径约为65nm,边缘粗糙。双层结构的轮状病毒由于缺乏外层蛋白,而不能参与病毒对易感细胞的侵袭,只有含三层结构的病毒颗粒具有易感性(Estes和Kapikian,2007)。
PoRV病毒衣壳组成
轮状病毒可分为7个亚型(A~G),虽然从形态学上很难区分,但根据抗原特异性,基于VP6血清型特征而加以区分(Estes和Kapikian,2007;Ssif和Jiang,1994)。在猪轮状病毒中,至少发现10个G血清型(G1~6,G8~10和11)。猪群中主要的G型为G3(CRW-like),G4(Gottfried-like),G5(OSU-like)及G11(YM-like)。
流行病学
虽然血清群的流行与猪的年龄相关,A群轮状病毒仍然在全球范围内广泛流行。在一些国家,成年猪群血清反应阳性率甚至可以达到100%(Bridger和Brown,1985;Brown等,1987;Chasey等,1986;Hung等,1987;Nagesha等,1988;Terrett等,1987;Theil和Saif,1985;Tsunemitsu等,1992)。猪B、C和E群的血清阳性率也很高。
在猪群中检测出轮状病毒A、B、C、E血清群,以及血清群A和C中的多个血清型。在腹泻样品中,A群轮状病毒的流行率为10%~70%,研究结果以分析方法、猪只年龄和区域等参数为依据。最近研究采用更为敏感的检测方法,比如逆转录PCR(RT-PCR),证实了轮状病毒A群在腹泻样品中的检出率很高(高达67%)(Halaihel等,2010;Katsuda等,2006;Kim等,2010;Lamhoujeb等,2010)。
A群轮状病毒在小于60日龄、甚至1周龄检测率最高。最普遍的发生于3~5周龄猪(Bohl,1979)。轮状病毒A群在排泄物中存在的持续时间约为7.4d,从1~14d不等(Fu和Hampson,1987)。排出病毒受被动免疫水平和轮状病毒血清群的影响。成年动物一般不常排出病毒,但它们偶尔会排出病毒,成为感染源。对于B群轮状病毒的感染,持续时间与病毒排出量要比A群轮状病毒少(Bridger,1980;Theil和Saif,1985)。
最近的数据表明,C群轮状病毒主要发生于7日龄以下的哺乳仔猪腹泻猪群(Rossow等,2010)。巴西2010年有报道指出,在腹泻和正常粪便样本中检出遗传多样性的猪C群轮状病毒。
存在于粪便中的轮状病毒在60℃(140℉)30min,或18~20℃(64~68℉)超过7~9个月仍然具有活力(Woode,1978)。2%戊二醛,70%%乙醇,3.7%甲醛,10%聚维酮碘,67%氯胺T,0.5%三氯生都可以使组织中的轮状病毒失活(Sattar等,1983)。能使轮状病毒失活的消毒剂包括酚类、福尔马林、氯气和β-丙内酯。消毒剂喷雾剂包括乙醇(0.1%苯基苯酚和79%乙醇)、漂白剂(6%次氯酸钠稀释到800ug/L游离态氯气中)和苯酚产品(14.7%石炭酸以1:256的比例稀释于自来水),以上消毒剂处理10min之后,可以有效减少95%~99%的病毒滴度(Sattar等,1994)。乙醇(95%)具有移除轮状病毒外层衣壳的作用,可能是最有效的消毒剂(Estes等,2001)。
致病机理
轮状病毒主要在小肠绒毛上皮细胞(Buller和Moxley,1988),盲肠或结肠上皮细胞(Collins等,1989;Theil等,1978;Ward等,1996b)繁殖。小肠的空肠段和回肠段最为敏感。接种后12~48h,几乎在全部的空肠和回肠绒毛上皮细胞和少部分十二指肠绒毛末端可以检测到轮状病毒抗原(Collins等,1989;Saif,1999;Shaw等,1989;Stevenson,1990;Theil等,1978;Ward等,1996b)。
轮状病毒在肠上皮绒毛细胞繁殖导致细胞溶解,绒毛变钝及萎缩。绒毛萎缩程度和病毒在小肠的分布情况取决于猪的年龄(Shaw等,1989)、轮状病毒毒株(Collins等,1989)和血清群(Saif,1999)。较年轻的猪群其绒毛的萎缩程度更加严重和广泛,猪轮状病毒A和C群与B和E群相比,能引起更加严重的绒毛萎缩(Saif,1999)。B群轮状病毒在小肠远侧段绒毛末端产生广泛的感染灶和轻度腹泻(Saif和jiang,1994)。
普遍接受的观点是轮状病毒诱导肠绒毛萎缩,使肠道吸收性细胞失去功能,引起吸收不良,导致腹泻(Kapikian等,2001)。除了绒毛萎缩,轮状病毒诱导腹泻的其他机制可能有肠道炎症反应(Zijlstra等,1999),肠神经系统的激活(Lundgren和Svensson,2001),轮状病毒NSP4d的肠毒素作用(Ball等,1996;Estes等,2001)。
临床症状
轮状病毒的潜伏期为18~96h,伴随着萎靡,腹泻,有时会有发热症状。天然感染轮状病毒伴发腹泻的猪多为1~41日龄的哺乳期猪只(Askaa等,1983;Bohl等,1978;Debouck和Pensaert,1983;Roberts等,1980;Svensmark等,1989;Yaeger等,2002)或断奶后7d以内的猪(Bohl等,1978;Lecce和King,1978;Tzipori等,1980b;Woode等,1976)。在特定的猪群内,开始发病的年龄经常具有一致性。
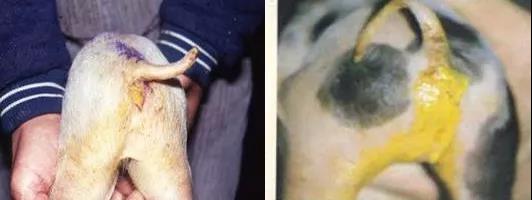
受感染的小猪腹泻呈黄色
在单一的轮状病毒感染病例中,轮状病毒没有与其他肠道病原体发生共同感染,哺乳期猪群的腹泻症状通常是轻微的,并且限于2~3d以内。粪便为黄色或白色,水样到奶油状、各种絮状。发病率不同,但一般小于20%。脱水程度轻微,在腹泻猪中,由于脱水致死的比率不到15%,青年猪死亡率最高。哺乳期猪群经常同时感染等孢子虫(Roberts等,1980)或者肠毒素大肠杆菌(ETEC)(Bohl等,1978)。共同感染会导致更严重的腹泻、更高的发病率和死亡率(Lecce等,1982;Tzipori等,1980a)。
有报道称,轮状病毒与传染性胃肠炎病毒(Bohl等,1978)或者β-溶血性产肠毒素大肠杆菌(ETEC)(Lecce等,1982;Tzipori等,1980a)混合感染,可引起断奶仔猪严重的腹泻。
病理变化
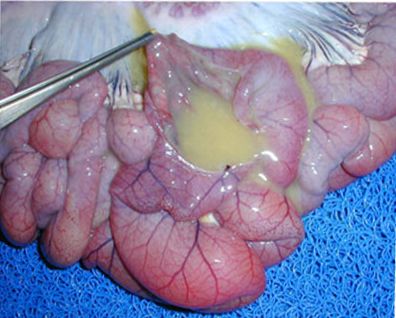
在小肠,典型的轮状病毒病理变化是由病毒复制造成的,导致肠绒毛的损伤和后续的适应性和再生性反应。大体病变最严重的主要见1~14日龄仔猪(Collins等,1989;Janke等,1988;Pearson和McNulty,1977;Stevenson,1990;Theil等,1978)。胃内通常含有食物,小肠末端1/2~1/3的部位肠壁变薄、松弛扩张,充满絮状、黄色或灰色的液体。小肠末端的2/3部位的乳糜管内无乳糜,肠系膜淋巴窦小且呈黄褐色。21日龄以上的猪很少见严重的大体病变,或者无可见的大体病变(Shaw等,1989;Stevenson,1990)。
肠壁变薄,内容物为黄色
对哺乳仔猪,光学显微镜(Paul和Stevenson,1999)和扫描电子显微镜(Collins等,1989;McAdaragh等,1980;Stevenson,1990;Torresmedina和Underdahl,1980)下的病理变化已有大量报道。肠绒毛上皮细胞的退化始于绒毛顶端,再接种后16~18h发生。退化的细胞肿胀,胞浆稀薄,核肿胀,刷状缘不规则,与临近细胞或者基底膜发生部分分离。接种后16~24h观察到细胞脱落,明显的绒毛萎缩,而接种到24~72h最为严重。萎缩的绒毛顶端发生溃疡,或者覆盖有肿胀的、细长的、近鳞形的上皮细胞接种后48~72h,由于隐窝上皮增生,使得深层隐窝明显可见。正常绒毛完全再生的时间取决于猪的年龄。
诊断
鉴于轮状病毒感染在新生仔猪中很常见,轮状病毒应当视作1~8周龄猪腹泻的一种病原体。要考虑到与其他传染病病原的鉴别诊断,包括大肠杆菌、传染性胃肠炎、猪等孢球虫和产气荚膜梭菌。轮状病毒的检测一般针对粪便样品、肠道内容物或是来自腹泻急性期的组织切片。因轮状病毒的排毒高峰期在初次腹泻后的24h内,所以样品收集时间是比较重要的。
许多有效的方法可用于检测轮状病毒,包括小肠冰冻切片或者小肠涂片进行电镜观察、免疫电镜、免疫组化、免疫荧光等观察,酶联免疫吸附试验(ELISA)、病毒分离、乳胶凝集试验、斑点印迹杂交、RNA电泳分型和RT-PCR(Kapikian等,2001)。
RT-PCR可用于检测病毒的RNA。RT-PCR则通过使用特异性的引物,成为轮状病毒检测,病毒基因分组和基因分型时最广泛应用的一种方法(Barreiros等,2003)。
因为猪群中轮状病毒感染率比较高,所以检测轮状病毒的抗体并没有太大价值。但是,可以通过检测免疫球蛋白M(IgM)和免疫球蛋白A(IgA)的抗体水平来评估猪的免疫状态。较高的IgM和IgA抗体水平表明是新近感染或急性感染。
免疫
轮状病毒感染可同时引发系统性和局灶性的免疫反应。轮状病毒感染后或口服免疫后,主要抗体反应是针对VP6,随后是VP7,VP4,NSP2和NSP4(Chang等,2001;Iosef等,2002a;Yuan等,2004)。经过轮状病毒的强毒感染康复后,猪对同型病毒(通常是P或G型)能产生保护力,而对异型病毒没有保护力(Bohl等,1982;Hoshino等,1988;Saif等,1997)0。这些结果显示,G型和P型特异性免疫反应对于控制轮状病毒感染的重要性。外衣壳VP4和VP7能诱导猪产生病毒中和抗体,并对同型轮状病毒提供独立的保护力(Hoshino等,1988)
尽管初次感染或疫苗接种为轮状病毒不同的血清群和血清型提供了较低的或者无交叉的保护力,但是反复的接种疫苗或再感染相同的病毒株,扩大了对异型轮状病毒的保护力范围(Chiba等,1993;Gorrell和Bishop,1999)。
给无菌猪口服接种人的轮状病毒,肠道IgA抗体分泌细胞和淋巴增殖反应的水平,与产生的保护力呈正相关,这强调了局灶性免疫反应对轮状病毒的重要性(Saif等,1997;Ward等,1996c;Yuan和Saif,2002)。在肠道和血清中存在的中和IgA抗体,是与保护猪和人类的轮状病毒疾病最为相关的因素(Azevedo等,2004;Coulson等,1992;To等1998)。
在仔猪出生后的很短的时间内(出生后24~36h),可以从免疫母猪通过消化初乳而得到母源抗体(Wagstrom等,2000)。而母源抗体仅能局灶性保护肠道(Saif,1999)。因此在母源抗体水平下降后,仔猪最易受到轮状病毒感染。初乳和乳汁中主要的抗体分别是IgG和分泌型IgA,因为后者对消化酶的裂解具有抗性,并且乳汁中含有更高水平的分泌型IgA,所以分泌型IgA在肠道里更能有效对轮状病毒产生保护力(Saif和Fernandez,1996)。母源IgG抗体被动地从血清渗透到肠道,也能短暂性地对轮状病毒感染产生保护力(Hodgins等,1999;Parreno等,2004;Ward等,1996a)。
预防和控制
没有专门针对轮状病毒的特效抗病毒药。因此,治疗仅限于使用抗生素和液体疗法,进行支持疗法和阻止细菌继发感染(Bywater,1983;Paul和Stevenson,1999)。为了减缓轮状病毒性腹泻造成的脱水和减重,采取含葡萄糖—甘氨酸的电解质溶液(Bywater和Ward,1980),或者向口服液中添加L-谷氨酸,以增加空肠对钾和氯的吸收(Rhoads等,1991)。口服给予转化的生长因子α可促进仔猪轮状病毒感染的空肠的恢复(Rhoads等,1995)。将含轮状病毒特异性抗体的鸡蛋粉额外添加到母猪的乳汁中,可降低2~3日龄仔猪腹泻的患病率(Henning-Pauka等,2003)。
室温对于降低哺乳仔猪因轮状病毒性腹泻而引发的死亡率是非常重要的。例如,当室温为35℃(97℉)时,死亡率显著下降(Steel和Torres-Medina,1984)。按照制定的饲喂程序给予高能量断奶仔猪饲料,亦可以降低轮状病毒感染的发病率和死亡率(Tzipori等,1980b)。由于轮状病毒在自然环境中普遍且持久地存在,因此从商业猪群中彻底清除轮状病毒是不实际的。所以在控制轮状病毒感染时,能够减少病毒积聚和敏感猪群爆发的管理规范才是实用的。成年母猪可呈亚临床感染,并向环境中排毒(Benfield等,1982)。为了减少病毒积聚,要搞好环境卫生。产仔舍和哺乳猪舍的地面应当建造成易清理的模式,尽可能减少粪便堆积,并且不同群的地面应当进行消毒处理。
而在对猪只的轮转病毒感染进行管理时,被动免疫也非常重要。后备猪应当暴露在年长母猪的粪便环境中,以增强轮状病毒的抗体滴度,以及增强被动免疫力。为了确保母源性免疫转移给仔猪,哺乳期日粮、采食量、舒适度和产仔笼的设计都应维持最佳状态(Paul和Stecenson,1999)。
目前,一种致弱的轮状病毒疫苗包含两种(G5和G4)主要的血清型,对哺乳仔猪进行口服免疫或肌内注射都有效(ProSystem® Rota,Merk Animal Health,Summit,NJ)。灭活的轮状病毒疫苗对母猪或哺乳仔猪的效力是不确定的(Saif和Fernandez,1996)。在哺乳仔猪体内,母源抗体可以通过诱导主动免疫来干扰轮状病毒病,并且一般能够引起致弱的口服苗失去效力(Hodgins等,1999;Parreno等,1999)。母源抗体可能对灭活的非肠道疫苗的抑制作用更小些。但是对轮状病毒血清反应阴性仔猪,肌肉注射灭活的轮状病毒不能够诱导肠道长生分泌型IgA抗体,或是提供保护力(Yuan等,1998)。
我国首个针对猪轮状病毒的活疫苗,由中国农业科学院哈尔滨兽医研究所研制,哈尔滨维科生物技术有限公司2015年3月24日正式上市,也是我国首个针对病毒性腹泻的三联活疫苗,有效控制混合感染。被动免疫,妊娠母猪分娩前40天和20天各注射1次;主动免疫,仔猪断奶后7天注射1头份;后备猪配种前注射2次,每次1头份;免疫途径:后海穴或(滴鼻+肌肉)。