
猪轮状病毒(porcinerotavirus, PoRV)是引起仔猪消化系统疾病的主要病原之一,感染后会引发以腹泻、呕吐、脱水和体重减轻为特点的急性肠道传染病。近年来,PoRV的检出率、流行率及发病率均呈明显上升趋势,且毒株多样性日趋复杂,给我国养猪生产带来了新挑战。PoRV的发生与流行不仅给养猪业造成巨大的经济损失,也对公共安全卫生构成严重威胁。本文综述了PoRV的基因组特征、病毒分离与流行情况、诊断与防控策略以及未来的研究方向,以期为PoRV的进一步研究与防控提供参考。
猪轮状病毒(porcine rotavirus, PoRV)自1975年首次发现以来,已在全球范围内普遍存在和广泛传播,对养猪业构成了严重威胁。 PoRV 主要侵害哺乳和保育阶段的仔猪,导致以腹泻、脱水、呕吐、厌食等为主要症状的消化系统疾病。尽管 PoRV 引起的死亡率相对较低,但其高发病率会导致发病猪生长缓慢和体重减轻,在饲养条件不佳、管理不当或与其他病原混合感染时可造成病情加重甚至引发大比例死亡,从而严重影响养殖效益。此外,研究发现 PoRV 还可感染支气管上皮细胞,临床和试验条件下均可在肺组织样本中检测到病毒核酸,表明其在呼吸系统疾病中可能扮演重要角色。然而,目前尚无特效药物针对性治疗猪轮状病毒病,疫苗免疫的临床效果也较为有限。 2018 年非洲猪瘟的传入使得我国生猪产业发生了前所未有的变化,值得注意的是,在此背景下 PoRV 的检出率、流行率及发病率均呈现明显上升趋势, PoRV 在我国的流行与演化日趋复杂,防控形势愈加严峻。本文针对 PoRV 的基因组特征、病毒分离与流行情况、诊断与防控策略等进行综述,阐明我国 PoRV 的流行与防控现状,为进一步深入研究 PoRV 的遗传演化、生物制品开发及综合防控提供参考。
1 轮状病毒的分子生物学特征
1.1 轮状病毒的病原学与基因组
PoRV 属于呼肠孤病毒目、光滑呼长孤病毒科、轮状病毒属。 PoRV 是一种分节段的双链 RNA 病毒,其全长基因组约 18.5 kb,由 11 个双链 RNA 片段组成,这些片段分别编码 VP1、VP2、VP3、VP4、nsp1、VP6、nsp3、nsp2、VP7、nsp4、nsp5 与 nsp6,共 6 个结构蛋白和 6 个非结构蛋白,其中 VP4 与宿主细胞相互作用后,可被蛋白酶水解成 C 端的 VP5 和 N 端的 VP8。成熟的病毒粒子直径为 60~80 nm,无囊膜,由 VP2 及少量 VP1 和 VP3 组成的内层、VP6 中间层及 VP7 和 VP4 组成的外层共 3 层衣壳蛋白及其包裹的双链RNA核酸组成。
1.2 轮状病毒的分群与分型
中间层衣壳蛋白 VP6 是 PoRV 中含量最丰富的结构蛋白,基于 VP6 蛋白的抗原特性,轮状病毒 VP6 基因的氨基酸同源性大于 53%,则被划分为同一种群。目前,全球范围内已发现的轮状病毒共分为 A 至 J 10 个种群,其中 A、B、C、E、H 这 5 种轮状病毒能够感染猪。猪 A 群轮状病毒(PoRVA)是最早被发现的 PoRV ,自 1975 年从澳大利亚的腹泻样品中分离后,便在全球多个养猪国家中流行,目前世界范围内也以 PoRVA 的流行为主;猪 C 群轮状病毒 (PoRVC)与 B 群轮状病毒(PoRVB)均于上世纪八十年代从美国俄亥俄州的腹泻猪群中发现。与 PoRVA 类似,PoRVC 在世界范围内广泛流行,而 PoRVB 的流行则相对较为局限,但巴西地区最新的调查发现 PoRVB 的检出率高于 PoRVA 与 PoRVC,提示 PoRVB 的流行情况可能正在发生变化;猪 H 群轮状病毒(PoRVH)主要在日本、巴西、美国与欧洲地区流行,而非典型的猪 E 群轮状病毒(PoRVE)的抗体仅在英国大于 10 周龄猪只中检测到,还未分离到病毒。
外层衣壳蛋白 VP7 与 VP4 具有诱导中和抗体的能力,基于两者的免疫学特性,通过血清交叉中和试验将轮状病毒分为 VP7 型(G 型)与 VP4 型(P 型)。随着测序技术的普及和进步,基于序列同源性分析的轮状病毒双重分型系统得到了广泛应用。 VP7 与 VP4 核苷酸同源性大于 80% 的毒株定义为同一 G 型和 P 型,截至目前,轮状病毒分类工作组已经鉴定出 42 个 G 型与 58 个 P 型。从全球范围看, PoRVA 中共发现了 12 个 G 型(G1-G6,G8-G12,G26)与 16 种 P 型(P[1]-P[8]、P[11]、P[13]、P[19]、P[23]、P[26]、P[27]、P[32]、P[34] ),而其中 G3、G4、G5、G9、G11与 P[5]、P[6]、P[7]、P[13]、P[28] 最为常见; PoRVC 中共发现了 12 种 G 型(G1-G9、G10、 G12、G13)与 7 种 P 型(P[1]-P[7] ),对于区域流行的 PoRVB 与 PoRVH ,文章及序列相对较少。为了更好地对越来越多的轮状病毒进行分型,轮状病毒分类工作组在 2008 年建立了基于核苷酸同源性分析的全长基因组分型系统,按照同源性80%、80%、85%、83%、84%、81%、79%、85%、85%、85%、 91%将 VP7、 VP4、 VP6、 VP1、 VP2、 VP3、 nsp1、 nsp2、 nsp3、 nsp4、 nsp5 和 nsp6 划分为 Gx-P[x]-Ix-Rx-Cx-Mx-Ax-Nx-Tx-Ex-Hx。根据该系统,截至目前轮状病毒的不同片段均存在超过 20 种以上的基因型。
1.3 轮状病毒的重排与重组
轮状病毒变异与演化频繁,不同毒株间容易发生片段间的重排现象。轮状病毒全长基因组分类系统的建立推动了轮状病毒全长序列的遗传演化分析,为分析不同毒株间片段的重排现象及潜在的跨种传播提供了有利工具。例如,人源轮状病毒 B4106 与兔源轮状病毒 30/96 具有相同的 G3-P[14]-I2-R2-C2-M3-A9-N2-T6-E5-H3 基因型,马源轮状病毒 H-1与猪源轮状病毒部分片段存在 G5-P[7]-I5-A8-E1 相同的基因型,Matthijnssens等利用该方法发现人、牛、猪源等多个物种轮状病毒存在广泛的重排现象。最近,Pathak 等利用该方法发现了两株蝙蝠来源的马A群轮状病毒 ERV4 与 ERV6 。Joshi 等对人源与猪源C群轮状病毒11个片段的分析发现猪可能是轮状病毒的中间宿主,其在轮状病毒的演化与跨种传播可能扮演了重要角色,而Wu等也发现猪是人源A群轮状病毒重要的储存器。Anastasia 等汇总了不同国家地区猪源轮状病毒在人群中的流行情况。除了不同物种之间,轮状病毒在试验室条件及同种间也会发生重排现象。Small等对实验室常用的猴源轮状病毒 SA11及其衍生毒株进行分析发现基因组存在明显的差异性,且发生了重排活动。猪A群轮状病毒在野猪与家猪之间的传播及其重排事件也屡见不鲜。此外,基因间重组也是轮状病毒不断变异与演化的重要机制。 Suzuki等首次报导了轮状病毒的重组现象,Parra 等发现了同基因型不同谱系轮状病毒的重组事件。随后,轮状病毒不同片段的重组活动被不断报道,Woods 等对797个A群轮状病毒的重组情况进行了分析,指出重组并不是轮状病毒演化及其多样性的重要机制,这可能与当时的毒株数量及分析技术有关。Hoxie 等对 NCBI中 23627条A群轮状病毒的全基因组序列进行了分析,结果证实了除 nsp3 与 nsp5外,其余9段均可发生明显的重组活动。同样,轮状病毒研究者均已发现并报道了C群、B群及H群轮状病毒的重组活动。
2 我国PoRV流行现状与病毒分离
2.1 我国PoRV的流行现状
我国对PoRV的研究最早可追溯到上世纪八十年代,1983年,廖德惠等发现乐山地区 108 例仔猪黄白痢中有46例是由轮状病毒感染所致,而丁再棣等、何家惠等对同时期江苏、浙江、上海、安徽、山东等地区哺乳仔猪腹泻样品的调查发现轮状病毒感染率极高,且在未吃初乳的仔猪身上成功复制出了该病,揭示了PoRV在我国猪群中的存在和流行情况。通过在中国知网上以“猪轮状病毒”为关键词进行搜索,发现,相比于其他主要的猪病毒性病原,我国对PoRV的研究并不多,且多集中在2010年以后(图1)。目前,我国将 PoRV 划为三类动物疫病,A、B、C、H 群 PoRV 在我国均有检出,但与世界范围内一致,主要以PoRVA的流行为主。近年来,尤其是非洲猪瘟传入我国以后,全国范围内整体上看PoRV的检出率、流行率及发病率均呈明显上升趋势,引起了科研人员及临床生产者广泛密切的关注。
非洲猪瘟进入我国以前,国内关于 PoRV 的流行病学调查及其相关文章并不多见。 Wu 等首次对临床健康且无任何腹泻症状猪只的轮状病毒感染带毒情况进行了检测与分析,其收集了2014-2017年覆盖整个台湾地区153个猪场的4588份粪便样品,发现PoRVA 的 PCR 阳性率为6.3%,流行毒株主要为 G3P[19](台湾中部地区)与 G9P[19](台湾南部地区),表明 PoRVA 在健康猪群中普遍存在且具有非常复杂的毒株多样性。Xue 等对山东地区2013-2014年间10个猪场226份腹泻仔猪的粪便样品进行了检测,发现6个猪场(60%)存在PoRVA的感染,样品阳性率为28.76%,G5与G9为主要的基因型。Tao等使用 RT-PCR 方法对2017-2019年我国东部地区35个猪场 594 个样品(包括健康和发病猪)进行检测,其中100份样品(16.83%)为PoRVA阳性,常新见等、徐丽华等对华东、浙江地区 PoRVA 的调查结果与此相符;Tao等进一步分析发现安徽地区 PoRVA 检出率高达82.4%,而浙江地区检出率仅为1.5%,表现出了 PoRVA 区域流行性的特点;然而,徐丽华等发现浙 江地区 PoRVA 感染在 2015 年上半年阳性率高达60.9%,其余年份均稳定在20%左右,这可能与两者的调查年份与样品来源及数量有关。张可发现辽宁地区 PoRVA 检出率逐年上升,由 2017 年的 7.89%上升至 2022 年的 24.00%;而周洪槿发现广西地区腹泻样品中 PoRVA 的阳性率高达 42.09%。周群等对 2017-2019 年四川省 14 个地区 40 个猪场 303 份仔猪腹泻样本检测发现 PoRVA 猪场阳性率为 62.5%,样品阳性率为 32.34%, G9 与 P[13] 为优势基因型, G9P[23] 为优势组合基因型。何晓明等对 2021-2022 年来自广东、广西、江西、湖南、云南、贵州 6 个省份 6472 份腹泻样品进行检测,发现 PoRVA 猪场阳性率为 65.12%,样品阳性率为 27.89%, G9 与 P[13] 为优势基因型,这与周群等的结果极为相似,但何晓明等的分析发现 G9P[13] 为优势组合基因型,这可能与区域流行性及毒株发生新的演化有关。 Qiao等在 2022 年从全国范围 23个省 230 个猪场收集了 25768 份哺乳仔猪腹泻样品,对我国当前 PoRVA 的流行情况进行了系统分析,结果显示,猪场阳性率高达 86.52%,样品阳性率高达 51.15%,最流行的优势基因型依然为 G9 与P[13] ,分别在 G 型与 P 型中占比 56.55%与 42.22%,从两者组合上看 G9P[23] 、G9P[13] 、G5P[13] 、G9P[7] 为主要的优势组合基因型;从区域上看,我国中部地区 PoRVA 阳性率最高,东部地区阳性率低于其他区域。
除 PoRVH 外,我国猪群同样存在 PoRVC、PoRVB、 PoRVH 的感染,尽管相关研究报道较少。在周洪槿的研究中,对广西地区 1447 份猪腹泻样本进行调查发现,PoRVA、PoRVB、PoRVC 和 PoRVH 的阳性率分别为 42.09%、 27.50%、 44.23%和 13.13%,而且混合感染比单一病毒感染更为普遍。乔成鹏对东北三省多个规模化猪场采集的 108 份仔猪腹泻病料和 15 份健康仔猪粪便样品进行分析,结果显示黑龙江省 PoRVA 阳性率为 47.4%,未检测到 PoRVB,而 PoRVC 阳性率为 5.3%;辽宁省与吉林省这3种轮状病毒的阳性率分别为 51.5%、 3.03%、 6.1%与 21.1%、 7.1%、 7.1%,并发现存在 PoRVA 与 PoRVC 混合感染的情况。此外,临床上我国 PoRVA 与其他病原混合感染的情况较为常见,尤其与腹泻相关的猪流行性腹泻病毒(PEDV)混合感染严重。
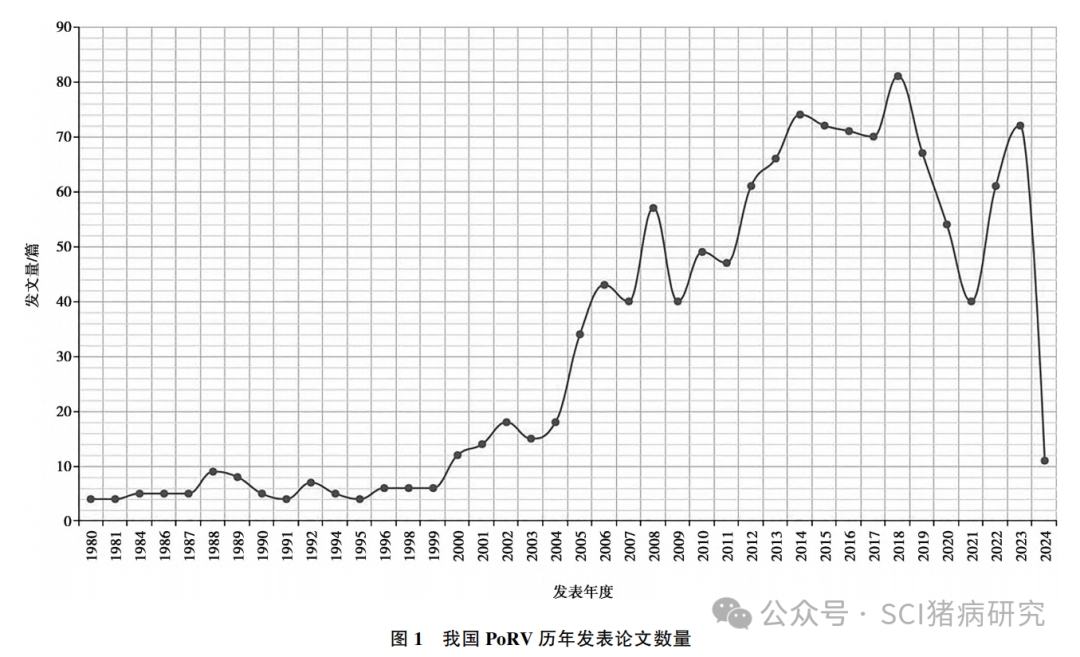
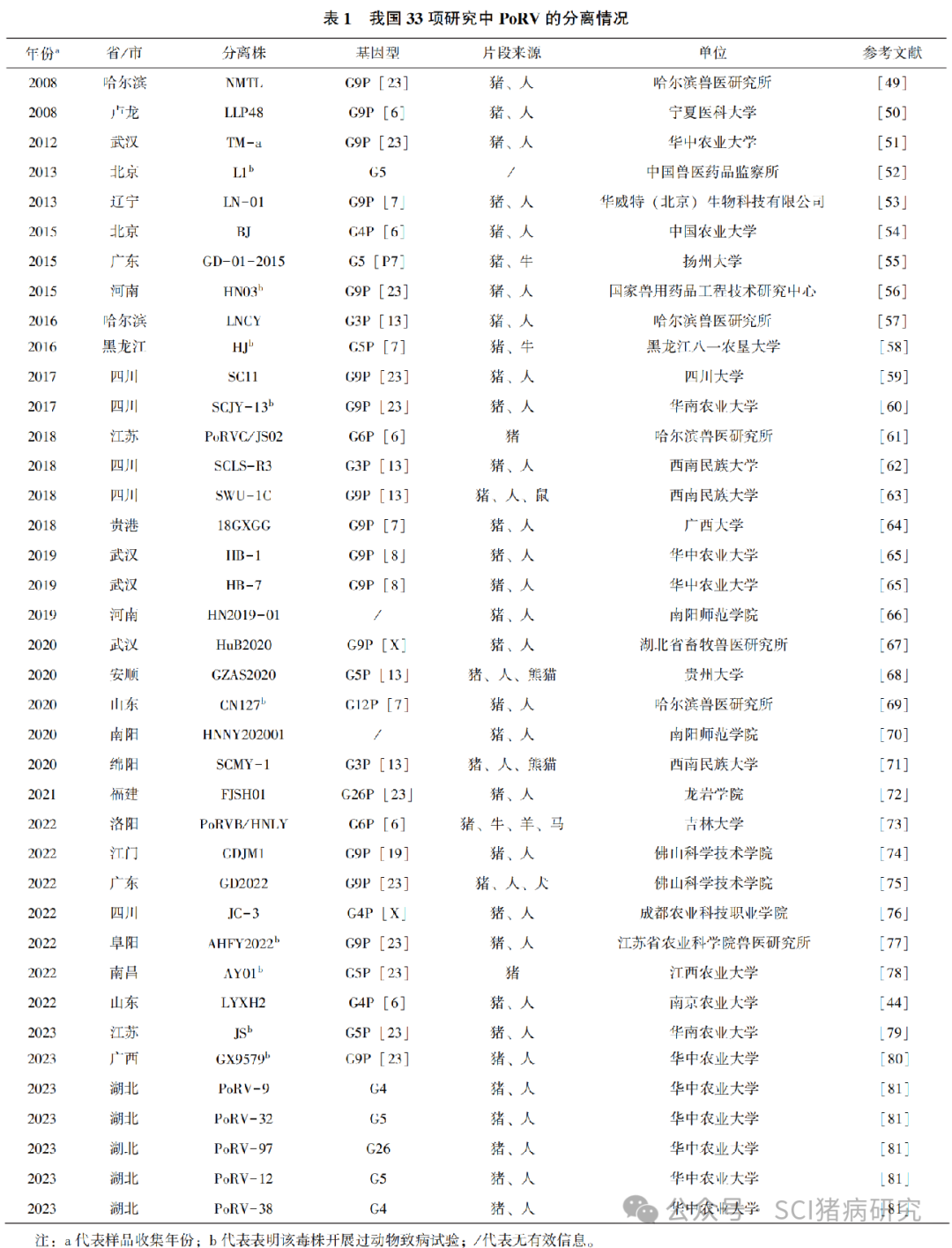
2.2 我国 PoRV 的分离及致病性
病毒的分离与体外培养是病毒研究的关键环节,轮状病毒的分离曾一度困难, 1977 年Theil 等用猪肾原代细胞成功分离并培养了轮状病毒,随后,Bohl 等则利用非洲绿猴肾细胞 MA104 成功分离了轮状病毒,使得轮状病毒的分离更加高效和可靠。我国的丁再棣等参照以上方法,在 1985 年首次成功分离了 4 株 PoRV。然而,直至 2010年前,国内关于 PoRV 的病毒分离与全基因组分析的文章仍然较少。我们对国内外期刊及博硕士论文发表的有关 PoRV 的文献进行了分析,共发现 33 项相关研究成功共分离了 37 株PoRVA、1株PoRVB 与1株PoRVC 。值得注意的是,超过三分之二的分离株均产生于 2018 年以后,由此可见我国 PoRV 近年来的流行程度和活跃度。在分离毒株的分型方面,主要的 G 型为 G9(16株)、G5(9株)、G4( (5 株) ),而主要的P型为P [23] (11 株)、 P[13](5 株)、 P [6](5 株)、P[7](5 株), G9P[23] 为最主要的优势组合型。有趣的是, 36 个 PoRVA 分离株中仅有1株(AY01)的基因组未发生任何重排活动,而其余毒株的片段来源于2~4个物种,其中猪源与人源占比最高,这提示需要加大对 PoRV 潜在的公共安全卫生风险的关注。此外,除了 PoRVA ,我们也应加大对其他群轮状病毒的监测。各分离株详细信息见表1。
我国 PoRV 致病性的研究相对较少。Wang等使用毒价为 107.6TCID50/mL 的第6代 HN03 毒株以2mL/头对3日龄仔猪进行攻毒,结果显示,24h后攻毒组猪只均表现出明显的腹泻症状,但在72h后逐渐康复;Wang 等使用毒价为 106.5TCID50/mL 的第 10 代 AHFY2022 毒株以2mL/头分别对5日龄和27日龄仔猪进行致病性试验,5日龄和 27 日龄仔猪均
出现腹泻症状,分别持续1d或3d,但未有死亡病例,并逐渐康复;林正丹对1日龄的仔猪进行致病性试验,发现感染 120h后死亡率为 66.67%;陈小飞等的攻毒试验结果显示发病率 100%,病死率 28.57%。Gao等对15日龄仔猪攻毒1mL G5P[23] 型毒株 JS(106TCID50/mL),感染猪的死亡率为 37.5%。这些表明 PoRVA 可导致哺乳仔猪100%发病与排毒,以水样腹泻、脱水、呕吐为典型症状,严重影响猪只的生长,然而致死率的差异可能由猪只日龄、攻毒剂量及毒株类型等因素造成。
3 PoRV的诊断
PoRV 的诊断需从流行病学、临床症状、剖检病变、实验室检测等多个方面进行综合判断。PoRV 主要引起1~8 周龄的仔猪发病,而中大猪及母猪多呈隐性感染状态。张子微发现 0~28、29~60、61~100日龄猪只及母猪的拭子样品中PoRVA的阳性率分别为 21.57%、27.98%、14.31%、5.10%。谢秀艳等对规模化猪场粪便样品进行PoRVA 检测,结果显示断奶仔猪的阳性率最高为 42.09%,24~35日龄仔猪的阳性率高达60%以上,而母猪阳性率仅为 1.5%。因此,从流行病学诊断上看, PoRVA主要感染断奶前后的仔猪,这可能与母源抗体的不断衰减有关。从临床症状与剖检病变上,感染 PoRV 发病猪与感染其他常见的可引起腹泻的病原,如温和型猪流行性腹泻病毒、猪德尔塔冠状病毒、大肠杆菌、仔猪球虫等,症状与病变极其相似,无特异性的显著差异。总体而言,PoRV 感染后的发病率与死亡率明显低于猪流行性腹泻病毒强毒株引起的仔猪腹泻,多呈一过性,但叠加仔猪日龄、生产管理、营养、气温季节、混合感染等因素后,也可引发高发病率与高死亡率。目前常用的 PoRV 检测与鉴定方法主要为电镜观察、病毒分离、 RT-PCR、 qPCR、胶体金、免疫组织化学染色及间接免疫荧光等,其中 qPCR 因其敏感性高、操作便利等优点被广泛应用于临床诊断,然而谢秀艳等发现无腹泻症状仔猪 PoRVA 的阳性率(55.08%)高于有腹泻症状的仔猪(36%),作为一种环境常在病原, PoRVA 的检出阳性率与临床感染发病之间可能无明显相关性,但检测Ct值(病毒载量)高低可能是判断轮状病毒是否有影响的重要指标。
4 展望
PoRV作为一种老病新发的病原,其导致的临床案例日益增多,病毒多样性也变得愈加复杂。这不仅给我国养猪生产带来了严重困扰,而且由于其潜在的人畜共患风险,对公共安全卫生构成了严重威胁。虽然近年来高校科研院所及临床生产者对PoRV的关注度逐渐升高,但对该病毒的认识仍然相当匮乏,许多关键性问题亟待解决。首先,应加强对PoRV的分子流行病学调查,深入了解不同地区、不同猪群病毒传播与流行的规律,探究分析疾病发生的致病因素及暴发后的经济损失,及时准确把握病毒的流行趋势及现状,为制定有效的防控策略提供科学依据。其次,通过研究PoRV的病毒基因组序列,分析病毒遗传变异、演化及重排、重组情况,探究病毒与宿主之间的相互作用,深入研究病毒的致病与免疫逃逸机制,为研发安全、高效且广谱的疫苗及特定靶点的药物提供理论依据。在检测技术方面,不断优化和改进现有的检测方法,以满足临床生产中快速、准确检测的需求。面对PoRV带来的新挑战,相信通过不断加强科研攻关,深化对该病毒的认识,不断完善技术手段和防控策略,一定能够有效地控制PoRV的传播和流行,保障猪群的健康安全生产,维护公共卫生安全。
最新发布