
由于在接种PCV2a或2d疫苗的猪场不断报告PCV2d感染的案例,我们尝试使用基于PCV2d的衣壳蛋白开发一种新型疫苗以增强其保护功效。在这项研究中,rPCV2a、rPCV2b和rPCV2d的重组病毒样颗粒(VLP) 分别由PCV2a、PCV2b和PCV2d野外分离株的衣壳蛋白合成。VLPs诱导抗血清和野外分离株之间的交叉中和试验证明了rPCV2d诱导抗血清的广泛交叉中和活性。然后,通过使用rPCV2d疫苗接种和PCV2d毒株和1型PRRSV毒株进行单一或双重攻击感染,研究了rPCV2d作为候选疫苗的保护功效。接种后3周诱导产生高水平的抗PCV2d的IgG和中和抗体。攻击感染后,接种组的平均ADWG值高于未接种组(p<0.05)。与未接种疫苗的猪相比,在接种疫苗的猪的血液、唾液和组织中发现PCV2基因组DNA减少。此外,在接种组中,组织中的宏观和微观损伤显著减少(p<0.05)。因此,这项研究表明rPCV2d疫苗可能对控制不同的田间基因型非常有用。
关键词:猪圆环病毒2型;重组VLP;疫苗;交叉中和
1. 简介
猪圆环病毒2型(PCV2)是多因素临床疾病(猪圆环病毒相关疾病,PCVAD)的主要病原体,给养猪业造成重大经济损失。此外PCV2和其他病原体(PRRSV、PPV和猪肺炎支原体)的共同感染增加了PCVAD的临床严重性,这可能是通过协同效应,这可能通过改变细胞因子的产生来调节PCV2的复制或清除[1,2,3]。
根据最近的报道,PCV2在全国约87%的猪场中检测到,其主要基因型是PCV2d[4]。此外,PCV2d基因型约占2016年至2020年间在韩国分离出的PCV2的95%[5]。这种从PCV2a和2b到PCV2d的基因型转变正在世界范围内发生[4,6,7]。
目前大多数商用PCV2疫苗都是使用PCV2a基因型衣壳蛋白作为活性成分制成的。据报道,当前的PCV2a疫苗可有效地交叉保护猪的PCV2d感染[8,9]。然而,PCV2并未从血液和组织中明显清除,尽管这些疫苗能够减轻临床症状。在我们之前的研究中,PCV2a疫苗免疫猪的抗血清对不同遗传背景的PCV2d分离株表现出不同的中和能力[5]。针对当前流行的PCV2的疫苗有效性的不一致有所增加[10, 11, 12, 13]。此外,由于疫苗效力低导致部分保护而导致接种疫苗的猪组织中残留病毒血症和病毒载量,这可能会导致平均日增重下降和出栏延迟,从而给养猪业造成严重的经济损失[14]。综上所述,该证据表明,可能必须根据PCV2野外分离株的遗传进化来取代当前基于PCV2a的疫苗。
目前的PCV2疫苗由基于ORF2表达的衣壳的病毒样颗粒(VLP)或灭活的完整病毒作为活性抗原制成,可有效用于控制PCVAD。考虑到PCV2-VLP的安全性和有效性,VLP最近被捧为下一代亚单位疫苗候选者。VLP是一种类似于没有病毒基因组的天然病毒的超分子颗粒,它是在单体结构蛋白组装后形成的,在宿主中表达为重组蛋白[15,16]。由于VLP是非感染性的,并且能够引发体液和细胞介导的免疫反应[17,18],基于VLP的疫苗技术是外源表位载体设计的好方法,已广泛应用于兽用和人用VLP疫苗的生产[19,20,21]。
在我们的初步数据中,PCV2d分离株(QIA244)未被基于PCV2a疫苗接种的抗血清中和,而QIA244菌株产生的抗血清能够有效中和PCV2a、2b和2d分离株。因此,在本研究中,我们生产了一种含有编码QIA244 ORF2序列的重组蛋白的PCV2d-VLP疫苗,然后评估其体外和体内有效性。
2. 结果
2.1. 由杆状病毒表达系统表达的VLP的生产
用重组杆状病毒株rAc-OP-PCV2a-ORF2、rAc-OP-PCV2b-ORF2和rAc-OP-PCV2d-ORF2感染Sf9细胞,分别产生表达PCV2a-ORF2、PCV2b-ORF2和PCV2d-ORF2。单体全长PCV2a-ORF2、PCV2b-ORF2和PCV2d-ORF2蛋白的分子量约为27kDa,在澄清的细胞裂解物的SDS-PAGE凝胶中显示为显性条带(图1a),并通过蛋白质印迹法证实使用多克隆抗PCV2抗体进行分析。在昆虫细胞中表达的PCV2a-ORF2、PCV2b-ORF2和PCV2d-ORF2蛋白被自组装形成VLPs,纯化的PCV2-ORF2蛋白通过TEM分析以验证PCV2a-VLPs的正确组装(图1b),PCV2b-VLP(图1c)和PCV2d-VLP(图1d)。VLP的大小约为17nm,呈二十面体对称。

图1. 表达的重组PCV2-ORF2蛋白的表征。PCV2-ORF2蛋白通过12% SDS-PAGE (a)分离。组装的PCV2a VLPs (b)、PCV2b-VLPs (c)和PCV2d-VLPs (d)被负染并通过透射电子显微镜(TEM) 观察。
2.2. 通过VLP诱导的抗血清进行交叉中和
为了评估VLP诱导抗体的交叉中和作用,用PCV2a (rPCV2a)、2b(rPCV2b)和2d(rPCV2d)VLP免疫的小鼠和猪的抗血清与PCV2分离株进行交叉反应,包括 PCV2a(QIA215)、PCV2b(QIA418)和PCV2d 基因型(QIA169和QIA244)(表1)。总体而言,小鼠和猪的三种rPCV2诱导抗血清显示出显著更高的针对 QIA215、QIA418和QIA169的NA滴度(小鼠为1075±400至6553±1003,猪为1024±512至5802±2389)高于那些(58±19)在小鼠中为819±307,在猪中为 75±28至725±299)对抗QIA244。此外,在三种rPCV2诱导的抗血清中,针对QIA215、QIA418和QIA169的NA效价没有统计学差异,尽管rPCV2d抗血清的平均NA效价高于其他rPCV2抗血清。在QIA244与三种rPCV2诱导的抗血清之间的中和作用方面。

表1.小鼠(n=5)和猪(n=3)中VLP(rPCV2a、rPCV2b和 rPCV2d)的中和抗体滴度(平均值±标准误差)。
2.3. rPCV2d疫苗接种对猪的保护效果
猪研究的设计如图2所示,详细的动物实验在材料和方法中进行了描述。

图2. 实验设计。随机分配5组25头仔猪:rPCV2d/PCV2-PRRSV (n= 5)、rPCV2d/PCV2 (n= 5)、rPCV2d/PRRSV (n=5)、rPCV2d/UnCh (n=5)和UnVac/PCV2- PRRSV(n=5)。仔猪在-21dpc(3周龄)时接种疫苗,在0dpc(6周龄)时受到攻击,并在21dpc(9周龄)时实施安乐死。在实验期间调查了临床体征、血清学分析(总IgG和NA滴度)、病毒血症、鼻拭子、组织病毒载量和病理损伤。
2.3.1. 临床体征和 ADWG
在攻击感染后的21天内,在任何接种疫苗的组中均未观察到临床体征,包括直肠温度、腹泻、抑郁和毛发粗糙,而UnVac/PCV2/PRRSV组确实出现了临床体征。如图3所示,UnVac/PCV2/PRRSV组的ADWG (0.45±0.11kg/天)略低于rPCV2d/PCV2/PRRSV(0.57±0.08kg/天)和rPCV2d/PRRSV组(0.55±0.09kg/天),代表PRRSV攻击,而它显著(p<0.05) 低于rPCV2d/PCV2(0.64±0.06kg/天)和rPCV2d/UnCh 组 (0.65±0.06kg/天)(图3)。
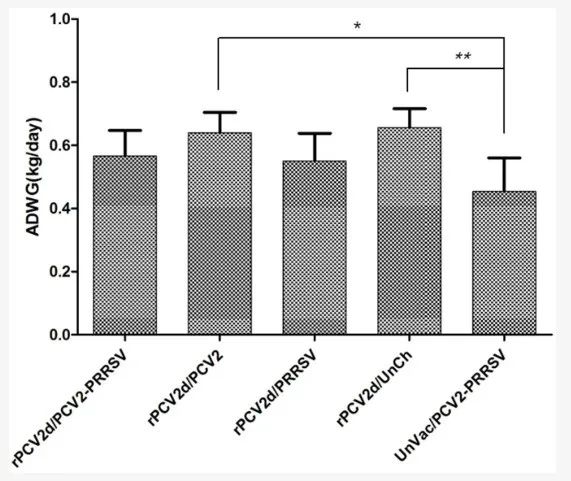
图3.平均每日增重(ADWG)。每周估计体重直到21dpc,ADWG(kg/天)在0到21dpc之间计算。* p<0.05和**p< 0.01表示差异显著。
2.3.2. 血液、鼻拭子和组织中PCV2和PRRSV的病毒载量
在血液和鼻拭子中,UnVac/PCV2/PRRSV组的UnVac/PCV2/PRRSV组从14至21dpc,而在所有接种组的猪中未检测到或几乎检测不到它们(图4a、b)。仅在PRRSV攻击组(rVac/PCV2/PRRSV、rVac/PRRSV和UnVac/PCV2/PRRSV)中检测到PRRSV基因组(图4c)。血液中PRRSV基因组的数量从7dpc(9±0.6到41±5.2拷贝)增加,达到峰值14dpc(35±2.6到39±3.2拷贝),然后迅速下降到21dpc(12±1.5到25±8.3份)。在21dpc的组织中,PCV2 基因组在所有rPCV2d疫苗接种组的组织中都是有限的或未检测到(表2),而在UnVac/PCV2/PRRSV组中检测到它们(肺部5237±3380,扁桃体19,720±11,795,肠系膜LN11,172±8150和腹股沟LN 3742±2488)。在组织中检测到PRRSV基因组(肺中 102±12至155±16,扁桃体中117±62至319±48,肠系膜LN中2.9±0.0至26±3.2和腹股沟LN中45±2.8至113±1.6)挑战与PRRSV的所有小组。
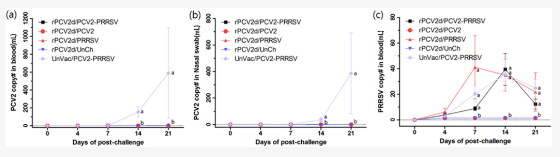
图4. 血液和鼻拭子中PCV2和PRRSV的定量分析。在血液 (a) 和鼻拭子(b)中检测到了PCV2基因组。还在血液中测量了PRRSV基因组(c)。rPCV2d/PCV2-PRRSV(■)、rPCV2d/PCV2 (●)、rPCV2d/PRRSV (▲)、rPCV2d/UnCh(▼) 和 UnVac/PCV2-PRRSV (◆)。不同字母 (a, b) 表示组间差异显著(p<0.05)。
表2. 肺、扁桃体、肠系膜淋巴结和腹股沟淋巴结中PCV2和PRRSV的病毒载量(平均值±标准误差)。
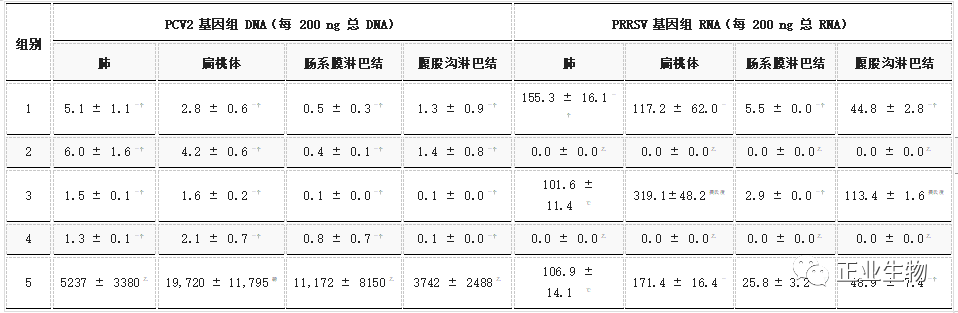
不同的字母 (a、b、c) 表示各组之间存在显著差异 (p<0.05)。
2.3.3. PCV2和PRRSV的血清学
使用包被PCV2d抗原的ELISA测定法,在rPCV2d疫苗接种组(rPCV2d/PCV2/PRRSV、rPCV2d/PCV2、rPCV2d/PRRSV和rPCV2d/UnCh)中从-7dpc观察到血清转化(图5a)。从7dpc开始,接种组(1434±675 至2458±410)的NA效价显著高于UnVac/PCV2/PRRSV组 (93±46)(图5b)。此外,在21dpc时,rPCV2d/PCV2/PRRSV和rPCV2d/PCV2组的VN滴度分别增加到6144±1295和7373±819,而对于rPCV2d/PRRSV和rPCV2d/UnCh组,它们从14dpc开始下降。UnVac/PCV/PRRSV组的NA滴度在21dpc时增加到1997±866。使用商业ELISA测定,从7dpc开始观察到血清转化,rPCV2d/PCV2/PRRSV和 rPCV2d/PCV2组在21dpc之前略有增加(图5c)。另一方面,rPCV2d/PRRSV和rPCV2d/UnCh组在21dpc之前保持接近负水平,而UnVac/PCV2/PRRSV组在 21dpc时变为血清阳性。关于PRRSV特异性抗体,在14dpc的所有PRRSV攻击组中均观察到血清转化(图5d)。
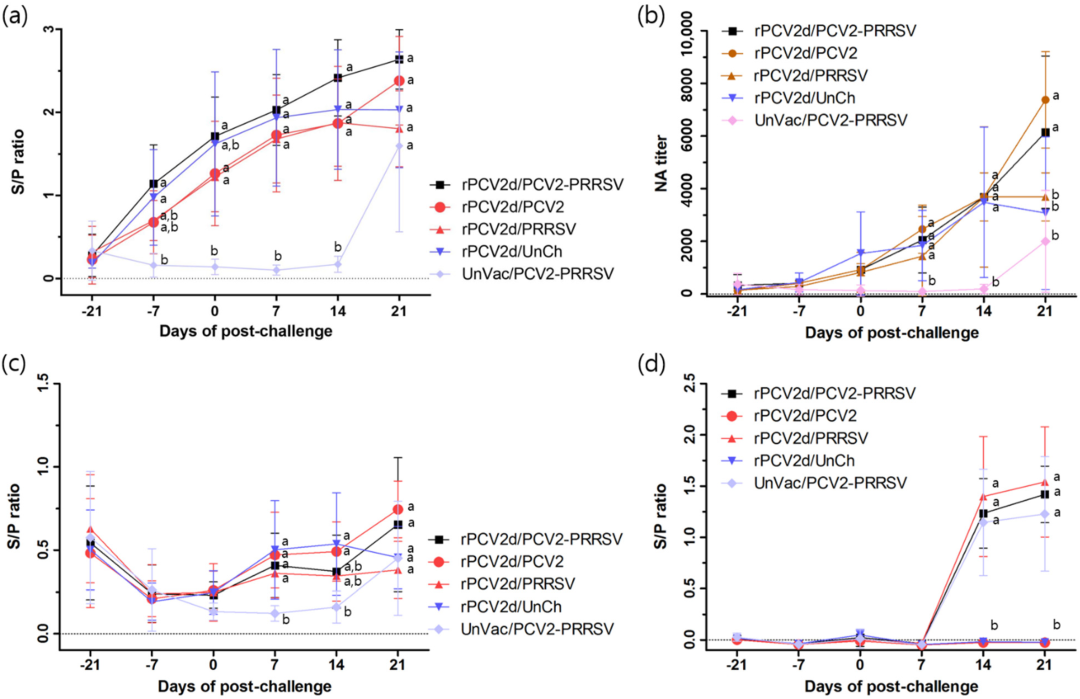
图5. 血清学分析:(a)使用基于PCV2d抗原的ELISA的PCV2 特异性抗体滴度;(b)血清中和抗体滴度;(c)使用基于PCV2a的ELISA的PCV2特异性抗体滴度;(d) PRRSV特异性抗体滴度。rPCV2d/PCV2-PRRSV(■)、rPCV2d/PCV2 (●)、rPCV2d/PRRSV(▲)、rPCV2d/UnCh(▼) 和UnVac/PCV2-PRRSV (◆)。不同字母(a, b) 表示组间差异显著(p<0.05)。
2.3.4. 肉眼和组织病理学病变
对宏观和微观病变进行评分,结果总结在表3中。来自 rPCV2d/PCV2/PRRSV(0.4±0.6和0.0±0.0)、rPCV2d/PCV2(0.2±0.5和0.2±0.5)和 rPCV2d/UnCh(0.0±0.0和0.0)的宏观病变(肺和腹股沟LN)评分±0.0) 组显著(p<0.05)低于UnVac/PCV2/PRRSV组(1.2±0.5和1.2±0.5)。病变主要在肺部观察到,如支气管周围淋巴细胞再生和间质性肺炎(S1,补充材料)。来自rPCV2d/PCV2/PRRSV(0.8±0.5和0.0±0.0)、rPCV2d/PCV2(0.0±0.0和 0.0±0.0)、rPCV2d/PRRSV(0.3±0.5和0.0)的微观损伤(肺和腹股沟LN)评分±0.0)和rPCV2d/UnCh组(0.0±0.0和0.0±0.0)显著低于UnVac/PCV2/PRRSV组(1.4±0.6和0.8±0.5)(p<0.05)。根据组织病理学分析,在任何接种组的扁桃体和两个淋巴结中均未检测到病变,而在UnVac/PCV2/PRRSV组中观察到轻度或中度淋巴细胞丢失和巨噬细胞增殖(图S2,补充材料). 就其他组织的宏观和微观评分而言,组间没有差异。
表3. 肺、扁桃体、肠系膜LN和腹股沟LN的宏观和微观病变评分(平均值±标准误差)。
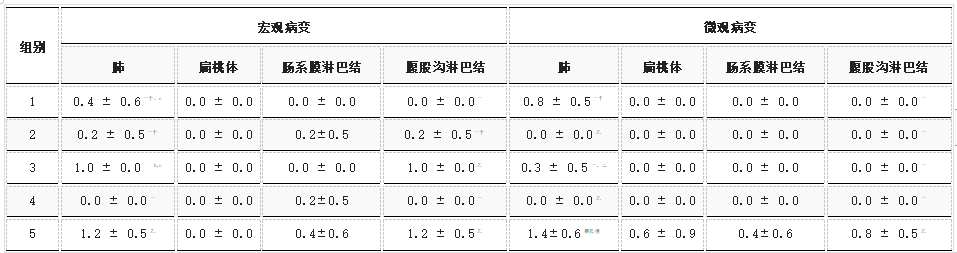
不同字母 (a, b, c) 表示组间差异显著(p<0.05)。
3.讨论
尽管在全国范围内广泛接种了PCV2疫苗,但PCV2一直在猪场中活跃传播,通过在田间诱发PCVAD导致持续的经济损失。先前的研究报告称,尽管基于PCV2a的商业疫苗被认为对PCV2d基因型具有临床保护作用[9,22],但在接种PCV2疫苗的猪场中,PCV2d毒株经常从临床患病的猪身上分离出来,这可能是由于疫苗失败[7,12]。最近对受PCVAD影响的农场分离株进行的遗传/抗原表征分析表明,在韩国,超过90%的PCV2以PCV2d基因型为代表,分离株在PCV2基因型或毒株之间表现出低中和交叉反应性[5]。有人提出,较低的交叉中和活性可能是PCV2活跃循环和接种猪场疫苗失败的原因。因此,使用由rVLP(rPCV2a、rPCV2b和rPCV2d)诱导的小鼠和猪抗血清作为PCV2疫苗的活性成分,研究了野外分离株之间的交叉中和作用。在测试的VLP中,PCV2d VLP显示出对几种野外分离株的广泛交叉反应,并且在猪中评估了其对PCV2d攻击感染的保护功效。
关于VLPs诱导抗血清的识别特性,所有抗QIA244毒株抗血清的NA效价均显著低于其他病毒,而rPCV2d诱导抗血清的中和效价显著高于其他VLPs诱导的中和效价。基于QIA244的VLP(rPCV2d) 展示了对不同基因型PCV2毒株的广泛识别,这在之前的一项研究中得到了重要反馈,该研究表明,由灭活的PCV2d基因型毒株QIA244诱导的抗血清显示出广泛的中和活性[5]。因此,使用rPCV2d作为候选疫苗预计会产生比目前基于PCV2a的疫苗更好的保护效果。另一方面,rPCV2d抗血清针QIA244的中和抗体效价(小鼠为819±307,猪为725±299)显著低于其他野外分离株(范围为4915±1389至6553±1003,in mice)和(2816±1280 to 5802±2389, in pigs),这是出乎意料的,无论基因型如何,这在未来的研究中值得关注。
为了使用rPCV2d评估疫苗接种效果,我们首先必须建立PCV2和PRRSV的双重感染模型,以便在实验条件下在猪中复制PCVAD,因为在商业仔猪中诱导了PCV2相关疾病的典型表现接种PCV2疫苗的母猪分娩需要PRRSV、PPV和猪肺炎支原体的混合感染[1,2,3]。在PCV2和PRRSV之间的关系中,PCV2不影响PRRSV的复制或损伤,而PRRSV增加了合并感染猪的血清和组织中的PCV2 DNA载量[23,24,25]。在本研究中,我们证实,与使用PCV2的单一攻击相比,PCV2野外分离株与1型PRRSV联合攻击可诱导组织中PCV2的高病毒血症和病毒载量,以及肺部病变增加。然而,PRRSV的致病性不受PCV2共感染的影响,证实PCV2和PRRSV的双重感染可用于适当评估新开发的PCV2疫苗的有效性。
rPCV2d疫苗接种在猪体内诱导了高水平的PCV2特异性IgG和中和抗体。为了评估PCV2d特异性IgG滴度,开发了使用PCV2d VLP的ELISA分析来克服不准确的免疫评估,这可能是由VLP(本研究)和野外分离株的抗原变异性引起的[5]。与商业ELISA试剂盒相比,自主开发的ELISA试剂盒证实了接种猪中诱导的PCV2特异性IgG滴度有着明显的时间变化,而商业ELISA试剂盒未能检测到PCV2d VLP疫苗接种的免疫反应,因为如图5所示C。ELISA抗原差异的影响表明,目前的商业ELISA试剂盒可能必须重新验证诊断性能或根据当前出现的基因型的抗原一致性重新开发。
一般来说,PCV2感染引起的临床体征和病理病变的缓解与病毒血症和组织病毒载量的减少呈正相关[9 , 22]。由于血液中的PCV2载量会导致生长表现不佳,从而最终延迟出栏[14],并且由于NA滴度水平与PCV2载量的减少显示出良好的相关性[26],随之而来的是更强的免疫反应和广泛的认可通过疫苗接种将是必要的,以更有效地防止野外分离。
在接种疫苗后3周(0dpc),NA滴度(819±338至1536±706)在接种组之间没有显著差异,而由于攻击后的记忆反应,接种组和攻击组显著增加感染。即使先前研究中接种疫苗后的SN效价[27,28] 在疫苗接种后42~75天内从1:32到1:64不等,建议本研究中疫苗接种诱导的SN滴度显著高于其他研究可能是不恰当的,因为PCV2的免疫水平似乎根据用于评估的试剂和程序而显著不同。然而,由于CircoFlex(勃林格殷格翰,Ingelheim,德国)诱导的平均SN效价,在猪的比较研究中,QIA244的QIA244为1:16,其他基因型PCV2为1:516-1024(数据未显示),开发的疫苗可能会诱导比商业疫苗更高水平的SN效价。
在本研究中,rPCV2d疫苗接种显示出针对PCV2感染的高水平保护能力。rPCV2d疫苗接种显著减少了血液和鼻拭子中攻击毒株QIA244的病毒脱落和病毒载量,这在与未攻击组(rPCV2d/UnCh)相似水平的PCV2基因组中很少存在得到证明。之前的一些研究报告说,即使在接种疫苗的动物中,唾液中仍有病毒分泌物和明显的病毒血症[27、29]。此外,rPCV2d疫苗接种可完全保护猪免受肺部和腹股沟淋巴结的宏观或微观病理损伤。有趣的是,尽管UnVac/PCV2/PRRSV组的肠系膜淋巴结和扁桃体没有明显的病理损伤,但在组织中检测到的PCV2病毒基因组水平高于肺和腹股沟淋巴结显示病理损伤的水平。病毒基因组水平与病理损伤存在之间的这种非相关性与之前的研究不一致[14,30]并应在未来进一步阐明。无论是否观察到病理损伤,rPCV2d疫苗接种成功地阻止了本研究调查的所有组织中的病毒载量。重要的是,接种组的平均ADWG值高于未接种组的平均ADWG值,这意味着接种rPCV2d应该有助于保护牲畜生产力免受PCV2侵害。同时,在1型PRRSV感染组之间的数据分析中没有观察到统计学显著性,表明PRRSV感染组的血液和组织中PRRSV病毒载量水平相似,表明哪个组受到PRRSV毒力的影响。因此,建议在评估PCV2疫苗接种的保护效果时,应更仔细地控制双重感染模型中使用的PRRSV的毒力。总的来说,这项研究表明,rPCV2d具有作为一种新疫苗的巨大潜力,可以保护猪免受目前流行的不同PCV2基因型(PCV2a、PCV2b和PCV2d)毒株引起的PCVAD,并具有增强的预防能力。