
2016年后,随着猪群中类NADC-30毒株感染的增多,类NADC-30毒株逐步成为中国的主要流行毒株(35%-55%之间)。从临床发病率和死亡率来看,与高致病性蓝耳病毒株相比,类NADC-30蓝耳病毒株感染猪的症状温和,死亡率较低。
我们知道能够引起猪腹泻的病毒性疾病有猪流行性腹泻、传染性胃肠炎、轮状病毒、猪瘟、伪狂犬等,但其实猪蓝耳病也会引发腹泻。此外,猪混合感染以上病毒后,可能会加重腹泻症状。本期文章为大家分享来自国内猪场分离的新型猪蓝耳病类NADC-30毒株引起仔猪的严重肠道感染和组织亲嗜性的一篇文章。
本研究发现:
1、 高致病性蓝耳病毒株(YL-2021)感染的仔猪表现出严重的呼吸道症状和较高的直肠温度,而类NADC-30毒株组感染的仔猪仅出现了轻微的呼吸道临床症状。但是,类NADC-30毒株感染的所有仔猪都出现腹泻,而高致病性蓝耳病株组没有。
2、 类NADC-30蓝耳病毒株(XM-2020)感染的仔猪中观察到严重的肠道病变,包括出血和粘膜损伤,而HP-PRRS毒株感染组与阴性对照组没变化。
3、类NADC-30蓝耳病毒株(XM-2020)在心脏,肝脏,脾脏,肺,肾等器官的病毒载量均高于高致病性蓝耳病毒株。
一种类NADC-30蓝耳病毒毒株引起仔猪严重的肠道感染和组织嗜性
A NADC30-like PRRSV causes
serious intestinal infections and tropism in piglets
全文链接:
https://www.sciencedirect.com/science/article/pii/S0378113522000670?via%3Dihub
摘要
猪繁殖与呼吸综合征病毒(猪蓝耳病病毒)给中国养猪业造成了巨大的经济损失。目前,发现了一种新的基因2型猪蓝耳病毒株,称为类NADC-30毒株,在中国许多省份流行。在这项研究中,我们从本地一家严重腹泻的养猪场收集粪便样本,然后用肺泡巨噬细胞(PAM)细胞分离到一株类NADC-30蓝耳病病毒毒株。在6周龄仔猪上感染高致病性蓝耳病毒株和类NADC-30蓝耳病毒株来比较两者的致病性。RT-qPCR显示肠中检测到类NADC30蓝耳病毒株,但未检测到高致病性蓝耳病(以下简称高蓝)毒株。对感染导致的病变部位进行组织病理学和免疫组化检查(IHC)进一步证实了肠内感染了NADC30蓝耳病毒株。根据临床观察和致病性实验,我们证实类NADC-30蓝耳病毒株有更广泛的组织嗜性,尤其是在小肠。这可能是自2013年在中国首次爆发以来,类NADC-30蓝耳病毒株成为主要流行毒株的一个原因。
1、简介
猪繁殖与呼吸综合征(PRRS)1987年首次在北美发现,自那以后,变成为了影响全球养猪业的关键因素。在中国,高致病性蓝耳病毒(HP-PRSV)从2006年首次出现至今为止,在15年的时间里给我国造成了巨大的经济损失。最近,类NADC-30毒株被频繁报道在国内引发大的流行。然而在流行的类NADC-30毒株中发现了新的发病特征,如中度临床症状、更强的免疫抑制和较弱的抗体。
最近,一家养猪场的母猪和生长猪群出现严重腹泻。通过RT-PCR或PCR检测排除了与猪腹泻相关的病毒,包括猪瘟病毒(CSFV),传染性胃肠炎病毒(TEGV),流行性腹泻病毒(PEDV),伪狂犬病毒(PRV),圆环2型病毒(PCV2)。出乎意料的是,我们在粪便样本中检测到猪蓝耳病病毒,并在更多粪便样本中得到了证实。由于普遍认为猪蓝耳病病毒有严格的细胞嗜性,因此很难理解该病毒会对肠道造成感染。而且参阅更多的参考文献也没有找到更有力的证据,尽管其中一些文献报导了在肠道或粪便样本中能够检测到蓝耳病毒。因此,确认这种现象是有意义的,这也是证明该病毒适应性增强的依据。
2、材料和方法
2.1 样本采集和病毒分离
我们从中国山西省运城市的一个猪场收集了包括肺和肝在内的组织样本,该猪场没有免疫蓝耳病疫苗,但是在2020年爆发了蓝耳病。在检测到样本蓝耳病毒核酸阳性后,将样本放在在磷酸盐缓冲盐水(PBS)中进行匀浆研磨,然后进行离心处理,再将阳性上清液通过0.22µm过滤器过筛。从无特定病原的仔猪体内获取猪肺泡巨噬细胞(PAM),用于从肺组织样品中分离蓝耳病病原体。当观察到大约70%的细胞病变(CPE)时,通过冻融技术收获病毒。然后在MARC-145细胞上的经过3次的噬斑纯化获得病毒。纯化后的病毒被命名为XM-2020株,用于进一步的全基因组测序和动物感染实验。致病性研究中使用的高蓝毒株(YL-2021,基因数据库登录号:MZ169406)由本实验室保存。
2.2 基因组测序和系统进化树分析
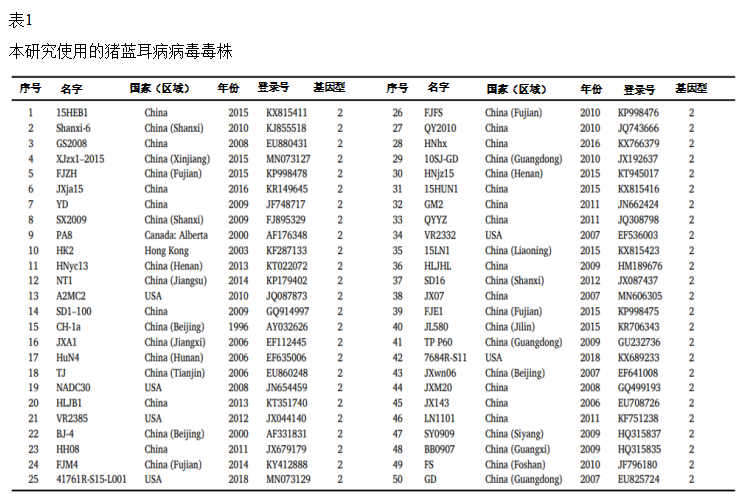
XM-2020株的全基因组通过二代测序(武汉贝纳根科技有限公司,中国)获得,并上传到基因数据库,登录号为:MZ160905.1。从基因数据库(附件表1)获得50个代表性蓝耳病毒基因组,以分析XM-2020株的进化关系。然后使用MEGA 6.06程序中的邻接方法构建了系统进化树,进行全基因组进化分析。通过使用1000个重复来检验系统进化树的可信度。
2.3 实验动物和病毒感染
将15头6周龄无蓝耳病毒、猪圆环病毒2型、伪狂犬病病毒和流行性腹泻感染的长白猪(选自中国山西咸阳当地农场)随机分为3组,分别为对照感染组(n=5)、YL-2021感染组(n=5)和XM-2020感染组(n=5)。每组仔猪分别在生物安全室中单独喂养,避免相互干扰。两个感染组的动物分别感染YL-2021(3×105 TCID50)和XM-2020株(3×105 TCID50),采取肌注(1 ml)和鼻内(2 ml)两种途径同时感染。对照组每头仔猪感染3 ml MARC-145细胞培养上清液,方法与上述相同。
感染后,每天记录所有仔猪的临床症状和直肠温度。定期从仔猪身上采集血液样本,以分析病毒载量和抗体水平。通过实时RT-PCR分析病毒血症的动态。通过靶向蓝耳 N蛋白的 VDPro 猪蓝耳 AB ELISA试剂盒(JBT,韩国)检测血清中的蓝耳病特异性抗体,并根据说明书将血清阳性阈值,即样品与阳性(s/p)比设定为0.4。所有的动物饲养工作都遵循动物伦理和人道使用的标准,所有实验猪在感染后14天安乐死。
2.4 猪蓝耳病毒的定量
通过TRIzol法(TaKaRa公司,东京,日本)从血液和组织样品中提取总RNA。使用超微量分光光度计(ThermoFisher,USA)评估RNA浓度和纯度。提取的RNA样品其OD260/280比值在1.8和2.0之间才可用于后续实验。然后按照说明书指导,使用StarScript II cDNA合成试剂盒(北京康润诚业生物,中国)生成cDNA,用PRRSV2特异性引物(上游:5'-CCAGATGCCGGTTGCTTGCTAGG-3';下游:5'-CACCARTGTGCCGTTGACCGTAGTG-3')进行实时定量PCR分析。使用含有蓝耳 M基因的质粒标准品进行连续稀释生成标准曲线。
2.5 病理和免疫组化分析
剖检时,收集包括心脏,肝脏,脾脏,肺,肾,肠,肠淋巴结和腹股沟淋巴结在内的组织样品,用于病毒载量检测。同时,将部分肺和肠浸入福尔马林中,进行组织病理学和免疫组织化学检查。然后,用苏木精和曙红(H&E)染色方法以可视化肺和肠组织样品中的病理变化。用兔抗PRRSV-N蛋白多克隆抗体(保存在我们的实验室中)进行免疫组织化学检查,以观察肠道中病毒颗粒的分布。
2.6 组织蛋白提取和蛋白印迹分析
从-80℃条件下保存的样品中,取出适量的组织,添加一些蛋白质裂解液(Minute™ Total Protein Extraction Kit for Animal Cultured Cells/Tissues, Invent Biotechnologies, Inc., Plymouth, MN, USA)。超声处理后,将样品置于冰上20分钟,在4℃以10000g离心约30分钟,转移到新试管中,并保存在-20℃。然后,对制备的组织蛋白进行蛋白质印迹分析。
样品通过跑SDS-PAGE凝胶电泳之后,将分离的蛋白质样品转移到硝酸纤维素膜(GE Healthcare)上。GE膜先用5%脱脂牛奶TBS(中国上海宇多生物技术有限公司)进行封闭,之后用含有2%BSA的TBST(含0.5%吐温-20的TBS)溶液适当稀释一抗(抗PRRSV-N蛋白多克隆抗体,抗内参多克隆抗体(阿卡姆,剑桥,英国)),4℃过夜。再与二抗(HRP标记的山羊抗兔IgG(上海生工,上海,中国))孵育2小时后,使用奥德赛红外成像系统(Li-Cor Biosciences, Lincoln, NE)观察蛋白印迹。然后使用ImageJ定量软件确定蛋白质印迹水平。每个实验样本重复三次,三次的结果相似。
2.7 统计分析
使用GraphPad Prism软件8.2.1(GraphPad software Inc.,San Diego,CA,USA)中的双向方差分析(ANOVA)对不同的直肠温度,以及血液和组织中的抗体水平和病毒载量的差异进行统计分析。当概率(P)值小于0.05时,差异被确定为具有统计学意义。图中带“*”的数字表明了两组之间的差异显著。所有数据均表示为平均值±SD。
摘要
3.1 系统进化树分析
XM-2020株全基因组为15040 bp,不包括多聚A尾。系统进化树是基于XM-2020株的完整核苷酸序列以及基因数据库中可用的另外50种代表性蓝耳基因2型毒株生成的。根据系统进化树,XM-2020株与1支系毒株相近(图.1)。
3.2 临床症状,抗体水平,病毒血症和组织中的病毒载量
感染后,对照组在整个实验期间均未观察到明显的临床表现。用高蓝毒株感染的仔猪表现出严重的呼吸道临床症状和高的直肠温度(图.2A),而XM-2020株感染组的仔猪在实验结束前出现了轻微的呼吸道临床症状。值得注意的是,XM-2020株感染组的所有仔猪都出现腹泻,而另一组的动物没有出现相关症状。高蓝毒株感染组和XM-2020株感染组的仔猪在感染后第10天开始抗体转阳(S/P>0.4),对照组的抗体在整个实验期间保持阴性(图.2B)。
从感染后第7 天到研究结束,所有感染的猪都可以检测到病毒血症,在整个实验期间(图.2C),对照组猪的血清样本中未检测到病毒血症。各种器官的病毒载量结果表明,类NADC-30蓝耳病病毒毒株感染组除肝组织和腹股沟淋巴结组织外,样本病毒载量均高于高蓝毒株感染组。另外,仅在来自类NADC-30蓝耳病病毒毒株感染组的肠样品中发现病毒RNA(图.2D)。在对照组仔猪的样品中未检测到病毒RNA(数据未显示)。
3.3 感官病变,镜检病变和免疫组化
剖检期间,在高蓝毒株感染的猪和类NADC-30蓝耳病病毒毒株感染的猪中均观察到肺实变,但在对照组的动物中未观察到(图3A)。同时,仅在类NADC-30蓝耳病病毒毒株感染组的仔猪中发现弥漫性肠出血(图.3B)。显微镜检查显示,两个感染组的猪均表现出间质性肺炎(图.3A)。对照组的猪肺镜检时未检测到病理损伤(图.3A)。肠道病理切片的观察显示,在类NADC-30蓝耳病病毒毒株感染的仔猪中观察到严重的肠道病变,包括出血和粘膜损伤,而在其它两组中未检测到明显的病变(图.3B)。此外,通过免疫组织化学检查感染仔猪的肺和肠中的蓝耳病毒抗原。如图.3A所示,蓝耳病毒感染组中所有仔猪的肺都充满了蓝耳病毒阳性信号。在对照仔猪的肺中未观察到蓝耳病毒阳性信号。与显微镜检查结果相同的是,蓝耳阳性信号仅在类NADC-30蓝耳病病毒毒株感染仔猪的肠粘膜中观察到(图.3B)。组织蛋白免疫印迹检测结果表明,类NADC-30蓝耳病病毒毒株感染仔猪的肠道确实感染了蓝耳病毒,而高蓝毒株感染组没有任何阳性信号(图.3C)。
4、讨论
猪蓝耳病仍然是世界范围内困扰猪生产的顽固性病原体,并且与其他RNA病毒类似,一直在发生快速突变。自2006年以来,高致病性蓝耳病病毒毒株大流行严重影响了中国养猪业的发展。2013年,中国出现类NADC30毒株并对养殖业造成巨大损失。此外,2016年后,中国许多猪群中类NADC-30毒株阳性率高于高蓝毒株,因此类NADC-30毒株迅速成为中国的主要流行毒株。近年来对类NADC-30毒株的致病性研究表明,与高蓝毒株分离株相比,其症状温和,死亡率较低。
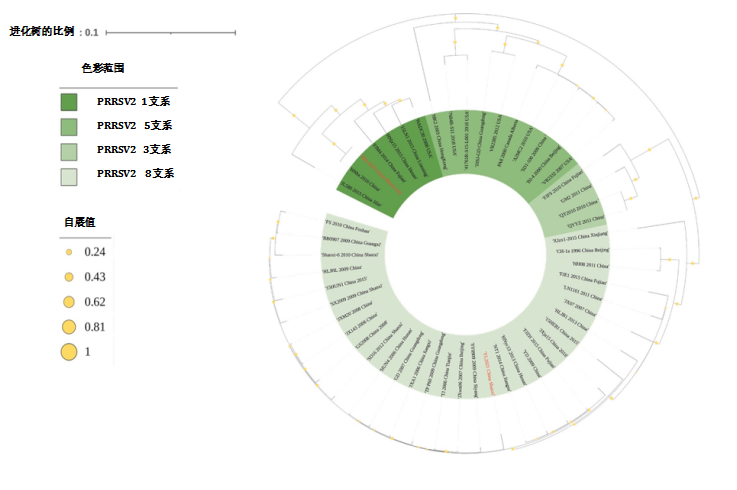
图.1.类NADC-30和高蓝毒株基于全基因组核苷酸序列的系统进化树分析。PRRSV2型分离株分为四个支系(支系1,3,5和8)。XM-2020株与1支系相近,而YL2021猪与8支系相近。每种病毒均以病毒名称,年份和分离国家/地区表示。不同的基因型和支系以不同的颜色显示。本研究中使用的病毒呈红色。每个节点表示1000次重排的自展值。比例尺表示每个位点的核苷酸替换。
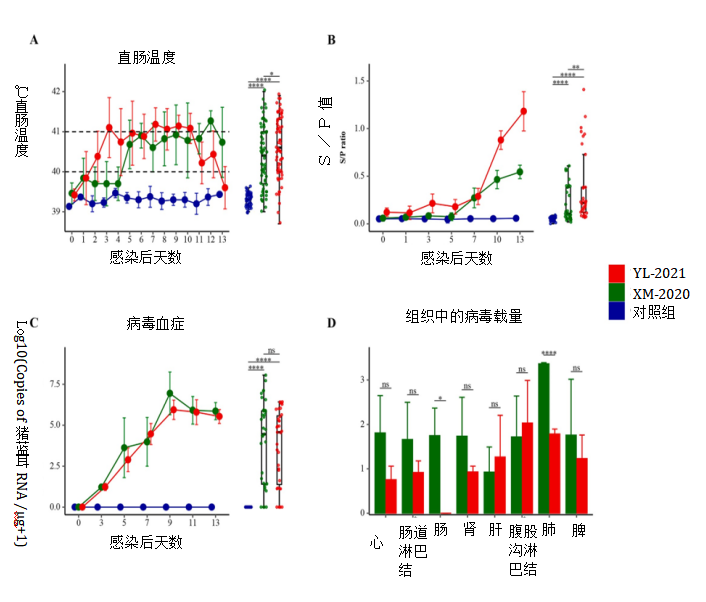
图2.感染期间组织中的临床表现,抗体水平,病毒血症和病毒载量。A、 感染类NADC-30毒株,高致病性蓝耳病毒株,或MARC-145细胞培养上清液的仔猪的直肠温度。显示了4个平均温度差异性(±SD);B、 感染后不同天数的猪血清中的蓝耳病毒特异性抗体。使用ELISA试剂盒VDPro PRRSV AB ELISA测定猪血清中的蓝耳病毒特异性抗体;C、 通过实时RT-qPCR测定检测病毒血症的动态;D、 通过实时RT-qPCR检测猪组织中的蓝耳病毒 RNA拷贝。
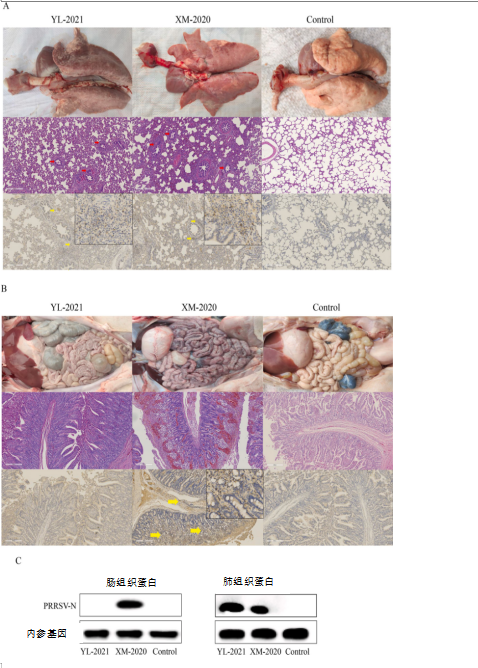
图.3.肺和肠样本的解剖病变,镜检病变和免疫组化。A:显示了代表性的镜检肺部病变。肺切片用苏木精和曙红(H&E)染色。红色箭头表示细支气管,肺泡间隔和肺泡间隙周围的炎性细胞浸润;B:显示了代表性的镜检肠道病变;黄色箭头表示蓝耳病毒的阳性信号;C:通过蛋白质印迹分析检测组织蛋白;用灰色强度分析软件定量蛋白质条带。
人们普遍认为蓝耳病毒具有严格的嗜细胞性。肺泡巨噬细胞、肺间质巨噬细胞和扁桃体中的CD163受体阳性巨噬细胞是PRRSV感染最重要的增殖细胞。但在猪蓝耳感染期间,中国猪群经常观察到以采食量减少和体重减轻为主的消化系统紊乱现象。有报道表明,猪在感染类NADC-30毒株期间可以观察到类似胃肠炎的症状。研究人员提出了各种猜想,但没有给出客观的解释。我们推测,这种对各种器官感染能力的增强可能是蓝耳病毒在进化中的关键突破。
分离出类NADC-30蓝耳病病毒毒株的猪场经历了猪蓝耳病爆发,仔猪表现出腹泻症状,当时被认为是猪蓝耳病继发的细菌感染导致。我们的研究证实,感染类NADC-30毒株的猪确实出现了胃肠道相关症状。动物感染研究表明,类NADC-30蓝耳病病毒毒株在仔猪中的致病性上比高致病性蓝耳分离株的致病性更温和。特别是,仅在类NADC-30蓝耳病毒株感染的猪中观察到肠道病变,因为高致病性蓝耳病毒毒株感染的猪没有表现出相关的损伤,并且通过免疫组织化学检查在类NADC-30蓝耳病病毒毒株感染的动物的肠粘膜中检测到病毒颗粒。不幸的是,在肠道中蓝耳病毒检测呈阳性之前,腹泻症状从未与肠道感染猪蓝耳病毒关联起来。因此,在感染研究期间从未收集粪便样本,这意味着粪便排毒的时间规律仍是一个谜团。
这种新现象是否与新的靶器官或新的受体有关尚不清楚。进一步研究参与类NADC-30蓝耳病病毒毒株感染的肠道靶受体不仅对了解蓝耳病毒的进化具有重要意义,而且对未来猪蓝耳的预防和控制也具有重要意义。因此,我们将分析类NADC-30毒株感染消化系统的分子机制。我们接下来的研究将重点揭示类NADC-30毒株具有更强适应性和传播能力的原因,试图为类NADC-30蓝耳病病毒毒株的防控提供新思路,为临床诊断奠定理论基础。
最新发布