
猪病学11版中文版已经上市,相对于英文版本,中文版本的价格便宜不少,但是对包括我本人在内的某些囊中羞涩的人而言,价格依然不菲,拥有此书尚属梦想。为此,我们将对大家关注的一些疾病单独翻译成文,供大家参考。
第43章呼肠孤病毒(轮状病毒部分)
概述
呼肠孤病毒科的病毒颗粒无囊膜,呈二十面体,直径约75nm,由3层蛋白组成的核衣壳。呼肠孤病毒科有两个亚科:光滑呼肠孤病毒亚科和刺突呼肠孤病毒亚科,分别包括6个属和9个属。该病毒科病毒可感染许多种宿主,包括哺乳动物、鸟类、爬行动物、两栖动物、鱼类、软体动物、甲壳动物、昆虫、植物和真菌。光滑呼肠孤病毒亚科、轮状病毒属的轮状病毒(rotaviruses, RVs)和刺突呼肠孤病毒亚科、正呼肠孤病毒属的呼肠孤病毒(reovlrtlses)可以感染猪。轮状病毒和呼肠孤病毒基因组分别由11个和10个节段的双链RNA (dsRNA) 组成。由于有分节段的基因组,呼肠孤病毒间和每个亚群的轮状病毒间的基因重组很常见。
轮状病毒和呼肠孤病毒在猪群中无处不在。轮状病毒是造成新生仔猪和幼龄仔猪腹泻的主要原因。但是,由于在健康猪和有呼吸系统、肠道和生殖系统疾病的病猪中均可检测到呼肠孤病毒,所以呼肠孤病毒与猪发病的因果关系尚不明确。
猪轮状病毒
重要性
轮状病毒(RVs)是引起人和包括猪在内的多种动物腹泻的主要病原。在有临床症状和亚临床症状的猪上均可以检测到轮状病毒。轮状病毒与肠道细菌共感染也时有发生,造成病情加重,包括脱水、腹泻和死亡。轮状病毒有10个群[A群(RVA) 到J群(RVJ) ],其中,轮状病毒A群、B群 (RVA、RVB)、C群(RVC)、E 群(RYE)和H群(RVH)在猪群上均有报道。
猪轮状病毒A群发现于1975年。非典型猪轮状病毒(非轮状病毒A群)发现于20世纪 80年代,被分为B、C和E群(RVB、RVC、RVE)。2011年,在日本猪群中检测到了轮状病毒H群,随后在巴西、美国和南非相继发现。虽然轮状病毒A群在猪群中分布最广且致病力最强,但轮状病毒C群被确认为是新生仔猪肠炎的重要病原,轮状病毒B群与大龄动物感染相关。轮状病毒E群和H群是否为重要病原体还有待研究。
病原学
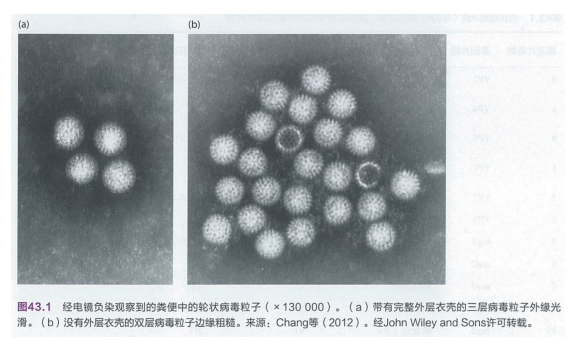
轮状病毒基因组由11个双链RNA片段组成,编码6个病毒结构蛋白(VP)1-4、6、7和5个非结构蛋白(nsp) 1-5。除了基因片段11在某些轮状病毒中编码nsp5和nsp6两种蛋白外,其他每个基因片段编码一个单独的蛋白质。轮状病毒独特之处在于 Nsp4蛋白产生的肠毒素参与病毒的致病机制。VPI、VP2和VP3蛋白组成病毒粒子的内层衣壳。中层衣壳由VP6蛋白组成,外层衣壳由VP7和VP4蛋白组成。VP4被蛋白酶裂解成VP5和VP8,用于吸附宿主细胞和产生感染性。电子显微镜下,包裹3层完整衣壳的轮状病毒粒子(内层、中层和外层衣壳)看似一个外表光滑的轮状粒子[图43.1(a)]。多种化学试剂和酶处理可以去除VP7和VP4组成的外层衣壳,剩下只有双层衣壳的病毒粒子,其外表变得粗糙[图43.1 (b) ]。
依据基因组的电泳图谱和空斑减少交叉中和试验,轮状病毒过去被划分为不同的种群。目前,基于VP6核苷酸序列同源性大于53%视为同一亚群的阈值,轮状病毒被划分为10种亚群(与RVA - RVJ对应)。依据基因组11个片段的核苷酸同源性阈值,也可对轮状病毒A群进行基因组分型。其他亚群的轮状病毒基于某些基因的核苷酸同源性也建立了类似的基因分型方法。轮状病毒毒株还可基于VP7或G基因型(糖蛋白VP7) 和VP4或P基因型(VP4的蛋白酶敏感性)这样的双基因型来进行分类。轮状病毒分类工作小组已经建立了轮状病毒毒株阈值化命名的体系,对基因库录入的每个轮状病毒株都完善了背景信息,如宿主种类、野生型或细胞适应型、分离国家、毒株名称、鉴定年份、G和P基因型。
轮状病毒上细胞培养的成功率各不相同。胰蛋白酶或胰酶通过裂解病毒外衣壳蛋白VP4,促进轮状病毒在细胞上的生长。轮状病毒在细胞培养中能产生显微镜下可见的细胞病变,如细胞圆缩,代表病毒在复制。
A群轮状病毒
恒河猴肾细胞系(MA104)可体外培养A群轮状病毒。HepG2肝细胞、胰岛细胞、结肠腺癌细胞以及其他肾细胞系也支持A群轮状病毒的生长。开发极化的小肠细胞系模型具有一定前景,因其可模拟体内病毒的生长和复制特点。大多数A群轮状病毒毒株在细胞上生长良好,但仍有部分毒株的细胞培养存在一定难度。
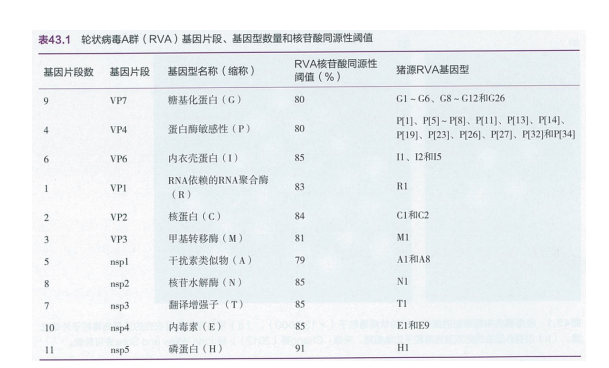
根据血清中和试验结果,A群轮状病毒毒株被进一步划分为27种G血清型。由于基因测序简便易行,血清中和试验很少被用于病毒型的划分。基于A群轮状病毒VP7基因序列对病毒进行G基因型分类时,将核苷酸同源性大于80%的毒株定义为同一基因型。迄今为止,所有已知的G基因型和血清型都相同。现已鉴定出18种P血清型。与G血清型和基因型分型结果完全一致不同的是,P血清型和基因型不一定对应;因此,已报道的不同轮状病毒P基因型用数字加方括号来区别[ (x) ],而血清型则不用加方括号。由于所需试剂短缺,用中和试验来对轮状病毒进行P血清型鉴定非常困难。因此,许多A群轮状病毒毒株只有P基因型。A群轮状病毒的P基因型也是基于VP4基因的核苷酸同源性大于80%的阈值。VP6、VP1、VP2、VP3、nsp1、nsp2、nsp3、nsp4和nsp5对应的基因型分别被定义为I、R、C、M、A、 N、T、E、H,各自以85%、83%、84%、81%、 79%、85%、85%、85%和91%核苷酸同源性为阈值对毒株进行基因型分类(表43.1)。
B群轮状病毒
鲜有成功细胞培养B群轮状病毒的报道。曾于1996年用添加胰酶的猪肾细胞分离单一的B群轮状病毒毒株(SKA-1), 但后期测序结果表明该毒株为H群轮状病毒毒株。由于细胞培养B群轮状病很困难,血清分型不可能,关于流行毒株的血清型仍属未知。然而,以VP7核苷酸序列同源性80%为阈值对 B群轮状病毒毒株进行分类,鉴定出21种G基因型。
C群轮状病毒
在含有高浓度胰酶或胰蛋白酶的MA104和原代猪肾细胞中,非常有限的几个C群轮状病毒毒株已培养成功。C群轮状病毒毒株进行G基因型分类时,以核苷酸序列同源性85%为阈值,而进行p基因型分类时,采用核苷酸同源性83%为阈值。迄今为止,C群轮状病毒毒株被划分为13个G基因型和8个P基因型。与 B群轮状病毒一样,C群轮状病毒毒株的细胞培养困难,通常不采用血清型对C群轮状病毒进行分类,因此只有G和P基因型的报道。
公共卫生
目前尚无轮状病毒在动物和人之间直接传播的证据。在患者中检测到动物源和人源重组的A群轮状病毒毒株,提示A群轮状病毒具有人兽共患病潜力。然而, B群、C群和H群轮状病毒具有独特的宿主特异性基因型特点,表明这些轮状病毒亚群不会在猪和人之间传播。
流行病学
轮状病毒普遍存在于猪群中,每头猪一生中通常会经历一次或多次轮状病毒感染。随着日龄增长,猪只存在多种轮状病毒的混合感染,代表猪一生中感染的轮状病毒的时间分布。猪的感染日龄是决定轮状病毒的感染率和疾病严重程度的最重要因素之一。主动免疫力未建立的仔猪和未从母猪获得足够被动免疫力的仔猪更易受到轮状病毒的感染。新生仔猪的易感性,加上母猪分娩时会轮状病毒排毒,一并增加了仔猪感染轮状病毒的概率。
轮状病毒粒子经感染动物粪便排出。它们具有高度的传染性,仅90 个病毒粒子就足以引起不吃初乳的仔猪发生腹泻和排毒。据估计每克粪便中含有1 × 1010个感染性病毒粒子,进一步增加了病毒的传播风险。轮状病毒污染物经粪-口传播,造成在猪群中迅速扩散。
轮状病毒普遍存在于环境、污染物甚至饮用水中。病毒在自然环境中相当稳定,完全干燥也不会灭活所有病毒粒子。如果持续使用卤素(氯制剂)或酚类消毒剂,有助于控制猪场中轮状病毒的传播。氯和戊二醛是去除衣物上肠道病毒最有效的消毒剂。
由于轮状病毒重组常见于每个亚群内的不同毒株间,因此数量庞大的G和P基因型的轮状病毒在猪群中持续存在,且在全球范围内占据主导地位的G和P基因型尚不清楚。此外,诊断调查结果显示多株轮状病毒共感染常有发生,但缺乏对共感染的全面研究。下面对每群轮状病毒的流行病学进行一个概要。
A群轮状病毒
A群轮状病毒感染的宿主范围非常广,包括人、牛、蝙蝠、肉鸡、火鸡、马、猫、犬、鼠和其他动物。
A群轮状病毒普遍存在于世界各地的猪种群中。近期流行病学调查显示,4.1%一89%的猪临床样本中有A群轮状病毒。在美国,A群轮状病毒常见于21-55日龄的猪群中,新生仔猪的感染率稍低。临床型A群轮状病毒感染的风险因素包括种群规模大、过早断奶和“全进/全出"的生产模式。据推测,连续生产体系下的保育猪轮状病毒感染率较低,因为母猪高度频繁接触轮状病毒,产生较高的母源抗体来保护仔猪。
猪上发现的A群轮状病毒到目前有12种G基因型/血清型(G1-G6、G8-12、G26)以及14种P基因型(P[1]、P[5]、P[6]、P[7]、p[8]、p[11]、p[13]、 P[14]、P[19]、P[23]、P[26]、P[27]、P[32]和P[34])。虽然P血清型鉴定不是区分猪A群轮状病毒毒株的常规方法,但已确认8种血清型:P1A、P2A-P2C、P7、P9、P12和P14,可能还存在更多的血清型。
B群轮状病毒
B群轮状病毒已在牛、人、山羊、羔羊、鼠和其他物种中发现。在B群轮状病毒的21个G基因型中,猪上已确认有 G4和G6-G21 基因型。目前,关于猪群中B群轮状病毒的P基因型和血清型等情况有待研究。虽然少数报道指出B群轮状病毒是引起新生仔猪腹泻的病原,但报道的感染率较低(1.6、4.9和47%),且多发生于3周龄以上的猪只。
C群轮状病毒
除了感染猪外,C群轮状病毒还可感染人、牛、雪貂、猫、犬和其他动物。猪上的C群轮状病毒已经确认11种G基因型(G1, G3, G5-G13)以及6种P基因型[ p (1)、 P(4)-P(8) ]。近期研究报道,C群轮状病毒感染率为19.5%-34%。在美国,C群轮状病毒是引起新生仔猪腹泻的重要原因,尤其是3日龄以内的仔猪。该年龄段仔猪通常是单独感染C群轮状病毒,随着日龄增长,常发生多种轮状病毒的共感染。这一年龄依赖性的C群轮状病毒感染模式还未在其他国家报道。
E群和H群轮状病毒
目前只有一起关于猪感染E群轮状病毒的报道,因此需要更多研究证实该结果的可靠性。最近,在猪和人中检测到H群轮状病毒。在美国和巴西,腹泻猪样本中H群轮状病毒阳性率达到15%和18%。因其与其他类型轮状病毒共感染的现象很是常见,所以最终确认H群轮状病毒是病原体前应进行详细调查。
致病机制
轮状病毒主要在小肠的空肠和回肠部分的上皮细胞中复制。病毒复制主要发生在小肠近端绒毛,导致绒毛变钝、萎缩。主要病理损伤常见于小肠。轮状病毒抗原在其他组织,如肺、肝、脾或脉络膜丛中可被短暂检测到,但并无病毒在肠道外组织复制的证据,且鲜有肠道外组织发生病变的报道。
外层衣壳蛋白VP4的亚基VP5和VP8通过与唾液酸相互作用,与易感细胞结合。尽管网格蛋白介导的内吞作用在某些猪A群轮状病毒毒株的感染中至关重要,但病毒进人细胞的共同机制尚不明确。
目前被人们广泛接受的轮状病毒引起腹泻的机制是绒毛脱落,导致液体吸收不足,进而造成吸收不良性腹泻。其他机制也可能导致腹泻。病毒进入易感细胞后,NSP4 破坏细胞内钙离子(Ca2+)调节,导致胞质内Ca2+ 水平升高。Ca2+可作用于氯离子(Cl一)的分泌途径,增加Cl一释放进入肠腔,最终导致腹泻。腹泻也可由NSP4介导的肠神经系统激活引起。
临床症状
轮状病毒感染引起不同程度的临床表现,从亚临床症状到极度严重的临床症状,主要取决于轮状病毒毒株、猪的日龄、免疫状况、整个群体的健康状况,以及是否存在继发性细菌或病毒感染。据报道,悉生(无菌)仔猪的潜伏期为17-48小时,而普通仔猪的潜伏期为1-4天。临床症状表现为大量水样腹泻、嗜睡、呕吐、厌食、迅速消瘦等。粪便颜色变浅或变黄,剖检时在肠道和粪样物中可见未消化的凝乳块。
普通饲养条件下的仔猪死亡率低于20%,但在有确诊病例存在时死亡率会更高。悉生(无菌)仔猪的死亡率可能相当高(86%-100 ‰)。7 日龄以内的仔猪腹泻持续1-10天,痊愈后通常很快恢复到正常体重。5日龄以上的仔猪一般临床症状较轻,病程较短。年龄较大的仔猪死亡并不常见。虽然轮状病毒感染可能引起严重病情,但亚临床感染多发生在55日龄以上的猪群。
临床症状的严重程度与多种因素有关,包括饮食和与其他肠道病原的共感染。营养不良会延长病猪腹泻的时间和延迟肠绒毛隐窝深度的恢复。除了一般性的营养不良外,维生素A是影响轮状病毒感染恢复的重要因素。与维生素A供给充足的猪相比,维生素A缺乏的猪腹泻时间更长、粪便中病毒载量更高、肠道损伤也更为严重。维生素A缺乏可能改变疫苗接种后B细胞的免疫应答,产生较差的免疫保护和较低的免疫球蛋白水平。最后,仔猪共感染肠毒素性大肠杆菌或A型产气荚膜梭菌,轮状病毒导致的腹泻更为严重。
病理变化
A、B、C群轮状病毒产生的病变相似。感染猪的小肠和大肠因含有过量的水状、黄色或灰色内容物而扩张。与未感染猪相比,感染仔猪肠壁变薄,胃也可能发生肿胀,内含未消化的凝乳块。
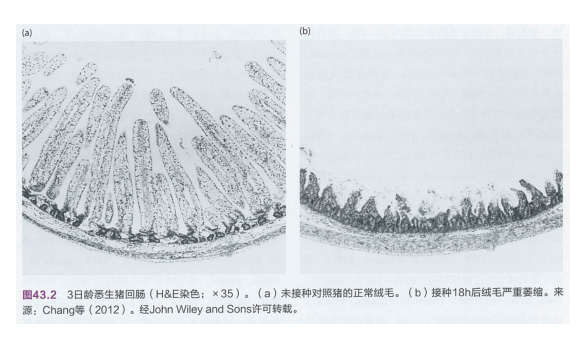
肠道组织学检查显示,早期感染的空肠和回肠上皮细胞肿胀,随着感染进程的发展变得更为明显。在感染约24小时后,回肠和空肠的上皮细胞脱落进入肠腔,导致肠绒毛变薄、变短(图43.2)。随后,绒毛被异常的立方上皮细胞所覆盖。绒毛变短常伴随肠隐窝延长和细胞增生。接种2-5天后,肠道形态开始改善,绒毛恢复正常长度。尽管肠道组织得到修复,但与未感染猪相比,接种感染3周后猪只的绒毛长度与隐窝深度比值仍然较低。
有研究报道,G9基因型A群轮状病毒毒株可引起肺、肝和神经系统等肠道外组织病变,包括间质性肺炎、肝细胞坏死和脉络膜丛变性。这就提示某些A群轮状病毒基因型感染可造成系统性扩散和损伤,然而,这种损伤是否由病毒复制引起还未确认。C群轮状病毒感染中,肺组织中可检出C群轮状病毒,但未出现病变,因此不能证实病毒在这些组织中发生复制。
诊断
轮状病毒主要影响新生仔猪,因此该年龄段动物发生肠道疾病时,应将轮状病毒纳入鉴别诊断病原。轮状病毒的临床症状与其他肠道病原相似,因此,在无实验室检测情况下无法做出判定。轮状病毒也可发生亚临床感染,因此在诊断时应予以考虑。
粪便或胃内容物可用于检测轮状病毒双链RNA 和抗原的存在与否。RT-PCR是检测轮状病毒最常用的诊断方法,定量PCR可确定样本中病毒浓度。随着多重RT-PCR检测技术的发展,可同时检测临床腹泻祥本中多种肠道病毒的存在情况。多重定量 RT-PCR (rRT-PCR)可以区分A群、B群和C群轮状病毒毒株。也可使用针对VP7和VP4基因的特异性引物鉴别不同的G和P基因型。
检测轮状病毒有许多其他方法,包括免疫层析试纸条测试、ELISA、血凝抑制试验、细胞培养免疫荧光和聚丙烯酰胺凝胶电泳。免疫组化、原位杂交或电子显微镜可用于死后确诊。可对肠道组织进行染色,检査其特征性病变,也可使用抗体染色对细胞内的病毒颗粒实现可视化。
ELISA、酶联免疫斑点法(ELISpot)、空斑减少中和法(PRN)或荧光斑点中和法(FFN)可用于测定仔猪或母猪对轮状病毒的免疫状态。评估VP7或 VP4的中和抗体水平最好使用空斑减少中和法(PRN)或荧光斑点中和法(FFN)。然而,这些检测方法需要细胞培养后的轮状病毒,因此对某些毒株的鉴定具有一定的挑战性。ELISpot方法常用于检测轮状病毒免疫猪和攻毒猪中抗体分泌细胞的特性。基于型特异性单克隆抗体的ELISA可定量测定轮状病毒lgA、IgG或IgM水平。
免疫力
轮状病毒感染可诱导产生全身和局部免疫力,强毒株比弱毒株引起的免疫反应更强。机体产生针对 VP7、VP4、VP6、nsp3和nsp4等5种蛋白的抗体,但其免疫反应的强度和类型因蛋白而异。虽然可检测到针对这5种蛋白的抗体分泌细胞和抗体,但只有VP7和VP4可诱导产生中和抗体。然而,血清中和抗体的水平并不能代表机体产生了保护性免疫力。
动物接种疫苗或暴露于轮状病毒强毒株后, 在肠道和血清中可检测到高水平、特异性lgA抗体,lgA的产生常被视为有了保护水平。肠道IgA抗体分泌细胞的数量可作为更好的免疫保护评价指标。
不同亚群的轮状病毒之间不存在交叉保护,猪上的同一亚群不同基因型的轮状病毒毒株间也很少存在异型免疫力或交叉保护力。只有当疫苗毒株的VP7和VP4片段与攻毒毒株高度同源时,机体才能产生最佳保护。此外,位于同一基因型不同分支的轮状病毒毒株间的交叉中和能力不强,因此无法判定交叉保护是否总是有效。但反复感染或多次疫苗接种可提高交叉保护能力。因此,疫苗接种应包括本区域内最为流行的轮状病毒基因型,进而提供最佳的保护范围。
目前,母猪提供的被动免疫是仔猪免受轮状病毒感染的主要方法。母猪通过初乳和乳汁为仔猪提供 IgG和IgA。IgA是哺乳期母猪体内持续时间最长的免疫球蛋白,但抗体水平在分娩后逐渐降低,在仔猪体内保持时间较短。跟母猪体内的抗体水平变化一样,仔猪体内母源lgG和lgM抗体水平随时间延长逐渐降低,直到仔猪产生主动免疫,抗轮状病毒中和抗体的水平增加。母猪初乳和常乳中的细胞因子可能具有调节免疫反应的功能,在激活Th2细胞和抗体产生中发挥重要作用。早期断奶和缺乏初乳可引起仔猪严重腹泻,证明母源抗体在保护仔猪免受轮状病毒感染中的重要性。
小鼠研究和几个悉生(无菌)仔猪的研究已经对T和B细胞在免疫接种后对轮状病毒感染的作用。结果表明,B细胞缺陷的前提下,攻毒后的临床症状的持续时间延长,但T细胞具有清除轮状病毒感染的能力。进一步清除B细胞缺陷的悉生(无菌)猪体内的CD8+T细胞,导致了动物免疫后更大量的排毒。攻毒时,CD4+ T细胞似乎能够发挥代偿作用,可产生与CD8+T细胞充足的猪相似的保护力。当然,这些动物不能产生长期免疫力,证明B细胞应答在免疫记忆中的重要性。
预防和控制
轮状病毒感染在猪群中普遍存在,从猪群中清除和净化轮状病毒是不切实际的。相反,目标应该是降低死亡率和腹泻发生率来减少轮状病毒感染产生的影响。维持母源免疫力是实现这些目标的关键。让母猪主动感染传染性轮状病毒可成功建立母源免疫力,但也会造成传染性轮状病毒污染分娩场地。即使是亚临床感染的母猪也会向环境中释放大量病毒。
已有防控A群轮状病毒的商品化疫苗,但还没有防控B群和C群轮状病毒的疫苗。一般来说,灭活疫苗不如基因致弱或传代致弱活毒疫苗有效。此外,母源抗体可能会干扰轮状病毒活疫苗的免疫效果。
最有希望用于疫苗研发的蛋白为VP6,因为其具有很强的免疫原性,可以诱导高水平的抗体和抗体分泌细胞。但单独使用VP6并不能刺激产生保护性免疫。鼻内接种VP6和VP2组成的病毒样颗粒,并与减毒的轮状病毒毒株联合使用,可诱导悉生(无菌)仔猪产生较好的免疫保护。其他具有潜在开发价值的疫苗还包括含有双顺反子表达质粒的鼠伤寒沙门氏菌疫苗或使用嗜酸乳杆菌作为更有效的佐剂。
缓解轮状病毒感染动物的有效措施包括保持适当的环境温度(35℃)和给断奶仔猪饲喂高能量饲料。注射电解质或L-谷氨酰胺,可防止由腹泻和呕吐引起的脱水,同时使用抗生素治疗细菌混合感染,可缓解病猪症状。注射TCF-α有助于黏膜修复。饲料添加剂可帮助治疗或预防轮状病毒感染。对轮状病毒腹泻仔猪使用甘草提取物可降低炎症细胞因子水平,对组织损伤的修复呈剂量依赖性。补充亮氨酸能够对抗仔猪空肠黏膜黏液素分泌的减少。体外研究表明,补充维生素D3可通过调节识别双链RNA的 RIG - I信号通路,降低轮状病毒的复制。用双歧杆菌和乳酸菌益生菌治疗仔猪可改善黏膜免疫应答,降低疾病的严重程度。
译者简介

李程
天康生物技术服务经理
硕士毕业于华中农业大学预防兽医专业,从事疫苗研发工作。曾在集团负责生产管理类工作,熟悉现代化猪场的生产管理,生物安全体系建设等。