
推荐导读
猪轮状病毒自然感染母猪产生的乳源免疫力的研究一直很少,2022年10月上线的最新研究《后备母猪分娩前返饲C群轮状病毒产生的抗体应答及其仔猪抗体水平》,填补了这方面认知的空白,于是匆匆翻译,分享给大家。
本研究首次发现:
1.最近的数据表明,C群轮状病毒是新生仔猪腹泻的主要原因,特别是在3天以下的仔猪中。返饲后的后备母猪初乳和仔猪血清中C群轮状病毒IgG和IgA抗体水平显著低于A群轮状病毒,这可能是新生仔猪C群轮状病毒感染率较高的原因。
2.初乳中轮状病毒特异性lgG水平在第0天最高,然后迅速下降,在第7天达到基线水平,并维持到断奶保持不变;而IgA抗体水平在第7天下降,然后逐渐上升,直到断奶。
3. 初乳中对A群和C群轮状病毒抗体水平的差异可能是由于后备母猪中两群病毒复制能力的差异。返饲材料中C群轮状病毒的ct值高于A群轮状病毒,病毒载量明显更低,不能诱导足够的免疫力,导致产房仔猪再次自然感染C群轮状病毒,而很少感染A群轮状病毒。
4.配种前和妊娠期间对母猪的返饲是诱导轮状病毒乳源免疫的最广泛使用的方法。还需要更多的研究来寻找增加返饲材料中C群轮状病毒病毒载量的方法。
Antibody Response to Rotavirus C Pre-Farrow Natural Planned Exposure to Gilts and Their Piglets
后备母猪分娩前返饲C群轮状病毒产生的抗体应答及其仔猪抗体水平
全文链接:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9610825/
摘要
开展一项纵向研究来了解后备母猪产前返饲C群轮状病毒(G6和P[5]基因型)(3次、或2次、或1次)引起的后备母猪血清、初乳(常乳)和仔猪血清中抗体水平的动态变化,并且和返饲A群轮状病毒(G4、G5、P[7]和P[23]基因型)的抗体水平做一比较。在哺乳动物细胞和细菌上表达C群轮状病毒的G6和P[5]抗原,用于建立间接ELISA方法。就G6和P[5]两种抗原而言,三次返饲组(组1)的初乳中抗原特异性IgG和IgA水平显著高于其他组。组1的仔猪血清在第0天和第7天的P[5]抗原特异性IgG水平显著高于其他组,而两种抗原特异性IgA水平均高于其他组。比较A群和C群轮状病毒诱导的初乳抗体发现,跟具体的G型、P型基因型无关,C群的IgG和IgA抗体水平都低于A群。二代测序(NGS)在乳源免疫力空白期的仔猪群中检测到返饲的C群轮状病毒(G6和P[5] 基因型)。该结果表明,返饲材料中低载量的C群轮状病毒(实时定量PCR Ct值为32.55、29.32、30.30)不能诱导后备母猪充足的母源免疫力(很低的C群轮状病毒初乳抗体),在产房不能阻止仔猪自然感染C群轮状病毒。据我们所知,这是首次在商品猪场比较A群和C群轮状病毒返饲诱导的抗体水平的差异。
关键词
猪;C群轮状病毒;自然感染(返饲);ELISA;测序
1、介绍
轮状病毒是呼肠孤病毒科轮状病毒属中的非囊膜病毒。11个双链RNA片段,编码6个结构蛋白(VP1、VP2、VP3、VP4、VP6和VP7)和5个非结构蛋白(NSP1-NSP5/6),全都囊括在一个18 kb轮状病毒粒子中。VP7是一种分子量为37 kDa的糖蛋白,占病毒蛋白的30%,形成外壳光滑的外表面。外壳的次要组成部分VP4蛋白以一系列刺突的形式从VP7外壳向外突出。VP4是蛋白是非糖基化的,分子量为88 kDa,占病毒蛋白的1.5%。VP4蛋白被酶解为VP5和VP8。VP8*形成病毒粒子的刺突,参与粘附宿主细胞和启动感染。VP7和VP4蛋白均能独立诱导中和性抗体和保护性抗体。
基于VP6基因序列,轮状病毒可以分为10亚群(A群-J群)进行了分类。在G型(VP7)和P型(VP4)测序的基础上,采用二元分类系统来描述大量轮状病毒的多样性。双基因(G/P)分类系统已扩展到一个完整的基因组分类系统,基于11个轮状病毒基因的全基因组测序,每个基因设置核苷酸同源性临界值。在轮状病毒10个亚群中,只有A、B、C、E和H亚群已经在猪上报告过。C群轮状病毒已在各个物种中被检测到,包括猪、人、牛、雪貂、猫和狗。猪C群轮状病毒于1980年首次被发现,目前被认为具有中等程度的流行率(4%-31%)。此前,A群轮状病毒被认为在猪中更为普遍和更具致病性,但最近的数据表明,C群轮状病毒是新生仔猪腹泻的主要原因,特别是在3天以下的仔猪中。G6基因型(70%)为主要的C群轮状病毒基因型,其次是G5型(17%)、G1型(12%)和G9型(1%)。据报道,美国的仔猪群体的轮状病毒流行率高达76.1%。
由于是上皮绒毛膜胎盘,猪在子宫内没有抗体转移。因此,仔猪完全依赖初乳和常乳中的母源抗体。母猪产生的IgG和IgA流向乳腺,并通过初乳和常乳转移到仔猪,轮状病毒在肠道中被中和。IgG是猪初乳中最常见的免疫球蛋白,可预防全身感染。分泌性IgA(sIgA)在常乳中更为普遍,与粘膜层面的保护有关。
C群轮状病毒在新生仔猪中的高流行率是养猪户关注的一个主要问题。流行病学数据表明,C群轮状病毒感染在新生仔猪中比断奶仔猪更为普遍,但其原因尚不完全清楚。可能的原因包括没有猪C群轮状病毒疫苗可用;初乳中母源抗体不足;与其他猪肠道病毒相比,C群轮状病毒感染仔猪所需的最小感染剂量较低;以及与A群轮状病毒相比,具有不同的致病机制。
尽管是1周龄以下的仔猪轮状病毒腹泻的最常见原因,但由于C群轮状病毒不能适应细胞培养,只有一种针对C群轮状病毒的疫苗。默克公司开发了预防轮状病毒的Sequivity载体病毒疫苗,用于产前的后备母猪/经产母猪。然而,它的临有效性数据缺失,无法评估其对猪C群轮状病毒的实际保护作用。因此,在美国猪群中,配种前和妊娠期间对母猪的返饲是诱导轮状病毒乳源免疫的最广泛使用的方法。将感染轮状病毒并发病的仔猪的粪便或肠组织内容物,喂给妊娠的后备母猪和经产母猪,以强化对轮状病毒的母源免疫力。返饲来控制猪C群轮状病毒感染的有效性的研究,目前还很匮乏。此外,目前还缺乏针对猪C群轮状病毒的商业ELISA,这阻碍了对返饲方案的有效评估。目前只有一篇报道使用基于C群轮状病毒病毒样颗粒(VLP)的ELISA检测后备母猪/经产母猪血清和乳汁分泌物中的基因型特异性C群轮状病毒抗体。因此,本研究采用自己开发的C群轮状病毒基因型特异性间接ELISA,来研究产前母猪返饲轮状病毒诱导的母源免疫力和仔猪获得的乳源被动免疫力。
2、材料和方法
2.1试验设计、返饲材料和取样
这项研究在美国一个1800头商用后备母猪,分娩到断奶,猪场进行。妊娠后备母猪被随机分为4个试验组。第1组在分娩前5、4、3周接受3次返饲,第2组在分娩前5周、3周接受2次返饲,第3组在分娩前5周接受1次返饲,第4组不接受返饲(对照组)(表1)。按照不同处理分区饲养母猪,禁止各组间母猪的混群。对46窝仔猪(第1组12窝,第2组12窝,第3组11窝,第4组11窝)进行粪便轮状病毒载量和抗体水平评估。
表1.返饲处理和样本收集(血清、初乳和常乳)计划。采样单独进行,包括后备母猪和每头后备母猪对应的5头只仔猪。
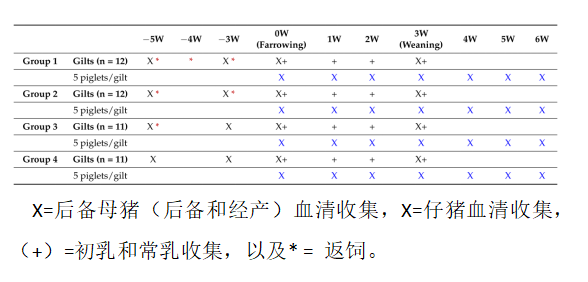
在研究前,对母猪场进行实时PCR监测,并根据猪场流行的A群轮状病毒和C群轮状病毒毒株准备返饲材料。饲喂给母猪的返饲材料中同时含有A群轮状病毒和C群轮状病毒毒株。在返饲材料中,母猪和仔猪对A群轮状病毒的抗体反应的细节已经在其他地方描述过。返饲材料是参考病毒建立毒种库的方法来准备,并储存在猪场的冷藏冰柜。用在后备母猪扩繁场收集的轮状病毒感染材料接种不吃初乳仔猪(n = 3)。24 h后,对仔猪实施安乐死,并处理其肠道内容物,制备返饲材料。为了制备返饲材料,将40 mL的肠道内容物(种毒)与约14 L的水和足够的饲料混合,得到100剂量(杯)的粥样混合物。每次返饲含有约237 mL的肠道内容物,每只母猪返饲1剂量的病料,每日喂食后5小时后完成。采集每个返饲病料的样本进行实时PCR检测和测序。分别于产前5周、3周、0周(产仔)和产后3周采集母猪血液样本。出生时收集初乳,分娩后1-3周收集常乳。在整个研究过程中,从每窝仔猪中选择5只仔猪来收集血清样本。在第0周(产仔)、产后1、2、3、4、5、6周采集每窝5只仔猪的血样,每只仔猪共7份血样。猪不允许在不同窝内交叉活动。此外,采血还注意选择健康的、视觉上体重接近的仔猪,以保持仔猪大小的一致性。
2.2 C群轮状病毒 VP7和VP4表达蛋白的构建
高通量测序在返饲材料中鉴定出G6和P[5] C群轮状病毒基因型。G6 VP7用哺乳动物Expi293TM表达系统(Gibco)表达,P[5] VP4用细菌表达系统表达。对G6 C群轮状病毒的VP7序列进行修饰,分别在N端和C端添加结构内8-组氨酸标签和链霉亲和素标签,跟踪重组蛋白的表达和亲和纯化。基因序列的密码子优化为哺乳动物的表达。在N端添加一个kozak序列,促进蛋白表达。在每个亲和标签之前都添加了连接子序列。CD5分泌信号在氨基端融合,将重组蛋白有效地分泌到培养基中。将合成的轮状病毒VP7基因亚克隆到pcDNA3.1+哺乳动物表达载体(InvitrogenTM)中。将P[5] C群轮状病毒蛋白截短体蛋白截短体VP4*(aa26-476)克隆到pET24a(+)载体中,带有一个连接子,羧基端有一个8-组氨酸标签。密码子优化、基因合成、克隆到pcDNA3.1(+)和pET24a(+)载体,以及基因序列验证外包给Genscript公司。
2.3 重组蛋白的表达、纯化与验证
将G6 VP7 pcDNA3.1(+)质粒转化到DH5α感受态细胞中,用阳性克隆在哺乳动物Expi293TM表达系统(Gibco)中进行重组蛋白表达。为了细菌表达,将携带P[5] 蛋白截短体VP4*的pET-24a(+)质粒转移到罗塞塔细胞(Thermo Fisher),在含有30µg/mL卡那霉素的LB琼脂平板上37℃培养过夜。单个菌落在20 mL卡那霉素LB肉汤中,37℃过夜振荡过夜。将过夜培养物加入1L含卡那霉素(30µg/mL)的LB肉汤中,以37°C振荡培养至OD值600约为1。加入终浓度为0.5 mM的IPTG,在16℃下振荡培养16 h。表达后,将细菌培养物离心,所得到的细胞团块用于蛋白纯化。重组蛋白采用固定化金属亲和层析(IMAC),使用爪钴树脂(Takara Bio, San Jose,CA, USA),遵循制造商提供的混合批次/重力程序,并进行了一些调整。亲和纯化的蛋白通过Western印迹法进行质量控制验证,纯蛋白组分用10K蛋白浓缩器进行浓缩。浓缩蛋白用BCA定量,并在−80℃保存直到进一步使用。
2.4 构建重组蛋白ELISA定量C群轮状病毒抗体
优化G6和P[5] C群轮状病毒的间接ELISA检测,检测猪血清和初乳/常乳中基因型特异性的C群轮状病毒 IgG和IgA抗体。采用棋盘式滴定法测定最佳包衣抗原浓度和二抗浓度(抗IgG和抗IgA)。其他ELISA参数,如包被条件、ELISA板孵育时间和温度,以及洗涤步骤也单独优化。ELISA抗体水平表示为A410值大于阴性对照孔平均值的两倍的最高稀释度的倒数。
2.5利用基因型特异性ELISA筛选母猪血清和乳汁及仔猪血清中C群轮状病毒抗体
血样2000g离心15 min获得血清,放置−80℃保存。初乳和常乳样品在4℃下5000g离心过夜,以分离脂肪、细胞碎片和乳清。使用无菌移液管尖端仔细分离脂肪层,并在无菌2 mL Eppendorf管中收集透明液体(乳清)。乳清被储存在-80℃度中备用。确定C群轮状病毒 IgG和IgA抗体终点水平,血清和初乳/常乳样品采用1×PBST准备的5% NFDM连续稀释(1:200、1:400、1:800、1:1600、1:3200、1:6400、1:12800和1:25600),添加两份100µL样品至免疫分析板反应孔,已经蛋白包被过夜,封闭和冲洗完。每孔加入抗猪IgG(1:10000,5%NFDM,100µL)和IgA(1:3000,5%NFDM 1PBST,100µL)结合辣根过氧化物酶(Abcam,Cambridge, UK),37℃孵育1小时。终点水平表示为A410值大于阴性对照井平均值的两倍的最高稀释度的倒数。如果任何样品的抗体水平大于稀释范围的高端(>1:25600),则对该样品进行更多的稀释测试(1:25600-1:102400)。每个ELISA板包含一个连续稀释的阳性和阴性对照,以避免板之间的变化。由于没有真正的阳性对照(针对每种蛋白的抗血清),少数高水平血清样本保存下来,并在整个ELISA检测过程中作为阳性对照,以保持样本检测的一致性。
2.6 高通量测序和实时荧光定量PCR检测返饲材料和仔猪粪便中的C群轮状病毒
将返饲材料中C群轮状病毒毒株的全基因组测序(WGS)与从仔猪粪便中回收的C群轮状病毒序列进行比较,以表征仔猪排出的C群轮状病毒毒株和返饲中的C群轮状病毒毒株之间的遗传差异。返饲材料在堪萨斯州立大学堪萨斯州兽医诊断实验室(KSVDL)分子NGS实验室的NGS进行了测序。使用直接zolRNA微型制备试次盒(Zymo Research, I轮状病毒ine, CA, USA)从返饲材料中提取轮状病毒双链RNA。我们采用单引物扩增技术(SPAT)程序从dsRNA中扩增cDNA序列。将P1引物(5‘CCGTCGACGAATTCTTT3’)退火到dsRNA上并提取。第一链合成是使用SuperScriptTM III第一链合成(ThermoFisher Scientific, Waltham, MA, USA),P2为P1互补的引物(5‘AAAGAATTCGTCGACGGG3’)。用LA Taq DNA聚合酶试次盒扩增cDNA(Takara Bio USA),PCR产物用QIAQuick PCR纯化试次盒进行纯化(Qiagen, USA)。高通量测序在Miseq(Illumina, USA)平台上进行。使用CLC基因组学工作台,使用从头和基于参考组装,对原始阅读框进行裁剪和组装(CLC Bio, CA)。
采用多重半定量实时荧光定量PCR(RT-PCR)方法检测返饲材料和粪便样本中的A群轮状病毒和C群轮状病毒,并报告为循环数(Ct)值。用Ct值的临界值为36来判定C群轮状病毒的样本为阴性。从第0-3周的样本中选择仔猪粪便样本进行测序,以评估在乳源免疫力存在下仔猪病毒载量。选择连续数周检测到C群轮状病毒且Ct值小于26(高C群轮状病毒载量)的窝仔猪进行测序。从所有4组中共提交30份仔猪粪便样本进行测序。仔猪粪便样本的全基因组测序(WGS)被外包给了乔治亚州亚特兰大市的疾病控制和预防中心(CDC)。
2.7 数据分析
治疗组和对照组之间的差异的显著性是由双向方差分析(ANOVA)确定的。采用GraphPad Prism 7进行统计学分析(GraphPad Software, USA),所有分析均采用p< 0.05的显著性水平。
3、结果
3.1重组蛋白表达
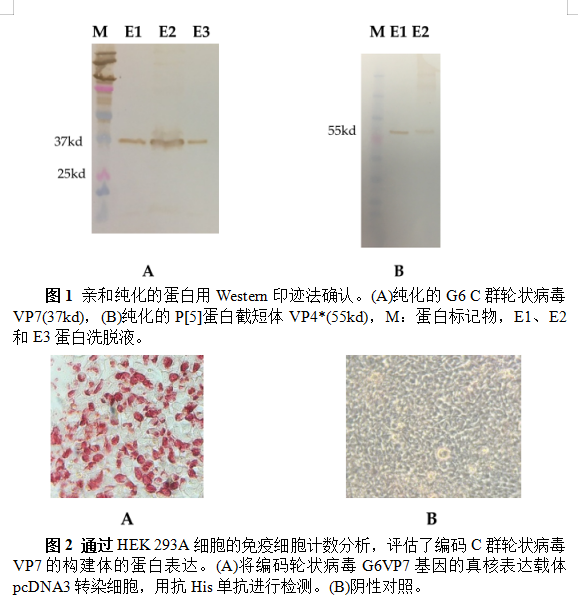
G6抗原被高效地分泌到Expi293细胞培养液中。使用抗His单克隆抗体在Western Blot上检测到与重组VP7和部分蛋白截短体VP4*预期分子量相一致的约为37 kDa和55 kDa的条带(图1)。与VP7相比,部分蛋白截短体VP4*的表达水平和产量较低。用携带G6基因的pcDNA3.1(+)质粒转染的HEK-293A细胞的免疫细胞分析证实了抗原表达(图2)。两种抗原的包被浓度为50ng/孔时获得最佳的ELISA OD值读数。用含0.05%吐温-20的1×PBST制备的5%NFDM封闭ELISA板,并在每个孵育步骤后进行四次洗涤。样品(血清/初乳/常乳)和二抗的最佳培养温度和时间组合为37°C,持续1小时。过氧化物酶结合IgG和IgA的浓度为1:10000和1:3000。
3.2 C群轮状病毒返饲抗体反应
3.2.1母猪血清
在产仔前5周完成第一次返饲之前,所有的母猪都有一定水平的C群轮状病毒抗体(图3A-D)。G6和P[5]基因的几何平均值分别在514.67-1198.55和2262.74-5079.68之间(图3A,B)。第1组完成2次返饲(产仔前5周和4周),第2组和第3组各完成1次返饲(产仔前5周),产仔前3周时G6和P的抗体水平均升高[5]。对照组在无返饲的情况下,产仔前3周时的抗体水平仅有轻微的升高。所有试验组的血清中两种抗原特异性Ig G抗体水平在分娩(F)时急剧下降,然后迅速反弹,直到分娩后3周(断奶)。所有试验组的P[5]基因型特异性 Ig G抗体的几何平均值在产仔前3周时均比G6基因型特异性Ig G抗体高出至少5倍(图3A,B)。产前5周的后备母猪血清中,G6基因型特异性IgA抗体的几何平均值为237.44–514.67, P[5] 基因型特异性IgA抗体的几何平均值为 236.77–503.97(图3C,D)不论返饲从次数,所有试验组血清中两种抗原特异性Ig A抗体水平在分娩前3周都增加了。对照组后备母猪产前三周血清中G6基因型特异性Ig A抗体水平有所下降,而P[5]基因型特异性 Ig A抗体略有上升(图3C,D)。与Ig G抗体水平一样,Ig A抗体在产后到断奶期间迅速上升。
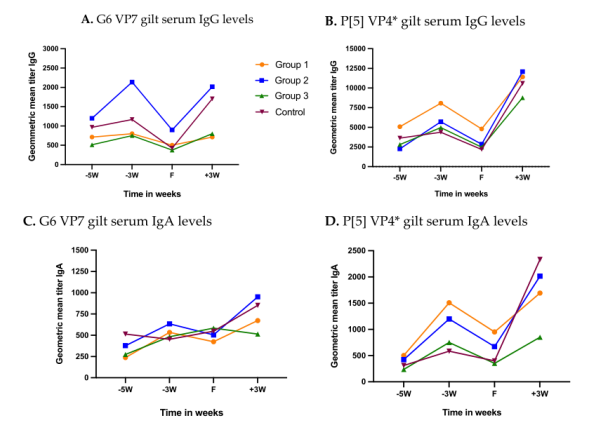
图3 C群轮状病毒返饲后备母猪诱导的血清抗体反应动力学。返饲3次(组1)、2次(组2)、1次(组3)或不返饲(组4)后,C群轮状病毒特异性Ig G和Ig A抗体水平随时间的变化。后备母猪在第0(F)周产仔。(A)G6 VP7特异性Ig G抗体水平,(B)P[5]截短蛋白VP4*特异性Ig G抗体水平,(C)G6 VP7 特异性IgA抗体水平,(D)P[5]截短蛋白VP4*特异性IgA抗体水平。横轴代表多个样本采集时间点(−5W=产前5周;−3W=产前3周;F=分娩时;+3W=产后3周或断奶时)。纵轴代表各个组抗体的几何平均值。
3.2.2初乳和常乳
在分娩时(第0天)采集初乳,然后每周间隔一次,直到断奶(第7、14和21天)。在分娩时,第1组(3次返饲)和第2组(2次返饲)的G6特异性Ig G抗体水平显著高于第3组(1次返饲),且数值上高于高于对照组(图4A)。在分娩时,第1组P[5] 特异性Ig G抗体水平显著高于第2、3组和对照组(图4B),第2组和第3组的抗体几何平均水平也显著高于对照组(图4B)。总体而言,在分娩时,第1组初乳中两种抗原特异性Ig G抗体水平显著高于第二组和第三组,并且显著或者数值上高于高于对照组(图4A,B)。正如预期的那样,初乳中这两种抗原特异性lgG白水平在第0天最高,迅速下降,在第7天达到基线水平,并在随后的采样点保持不变(图4A,B)。
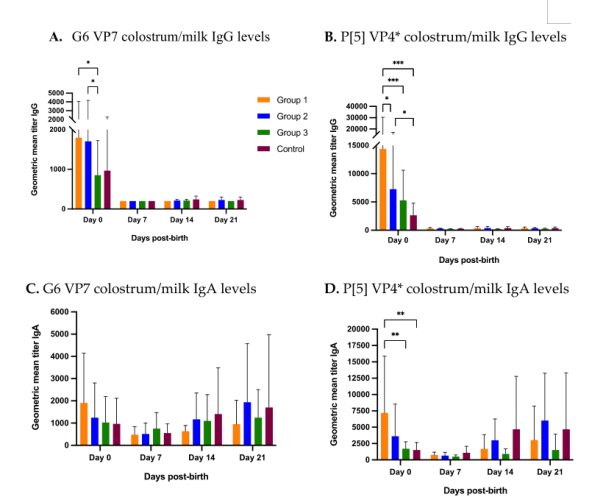
图4 各个时间点初乳和常乳中C群轮状病毒特异性抗体水平。返饲3次(组1)、2次(组2)、1次(组3)或不返饲(组4)后,后备母猪初乳和常乳中C群轮状病毒特异性Ig G和Ig A抗体水平随时间的变化。后备母猪在第0(F)周产仔。(A)G6 VP7特异性Ig G抗体水平,(B)P[5]截短蛋白VP4*特异性Ig G抗体水平,(C)G6 VP7 特异性IgA抗体水平,(D)P[5]截短蛋白VP4*特异性IgA抗体水平。横轴代表多个样本采集时间点(−5W=产前5周;−3W=产前3周;F=分娩时;+3W=产后3周或断奶时)。纵轴代表各个组抗体的几何平均值 (*p<0.30;**p<0.002;*p<0.001)。
在分娩时,G6基因型特异性IgA抗体水平在数值上高于其他组(图4C)。相反,第1组初乳P[5]基因型特异性IgA抗体水平显著高于第3组和对照组,并且在数值上高于第2组(图4D)。总体而言,IgA抗体水平在第7天下降,然后逐渐上升,直到断奶(图4C,D)。第2、3组和对照组在断奶时常乳中两种抗原特异性IgA水平达到或超过它们在初乳中的水平。然而,第1组两种抗原特异性IgA水平在断奶前各个采样点的水平都没有达到初乳的IgA水平(图4C,D)。截短蛋白VP4*(P[5])特异性Ig G和Ig A水平数倍高于VP7(G6)特异性Ig G和Ig A水平(图4A-D)
3.2.3仔猪血清
仔猪出生后每周采集一次血清样本,直到6周龄(42天)。在出生时(第0天),所有组的G6特异性Ig G水平都没有有显著差异,抗体水平几何平均值从最低的对照组的729.38到最高第1组的810.76(图5A)。然而,出生时第1组P[5]特异性Ig G水平(几何平均值 4177.68)显著高于第2组(几何平均值 2914.92)、第3组(几何平均值 3307.38)和对照组(几何平均值 2527.28)(图5B)。第7天,第1组P[5]特异性Ig G水平仍显著高于其他组(图5B)。
G6特异性Ig G水平在第28天前呈逐渐下降趋势(图5A)。所有试验组的G6特异性Ig G水平在仔猪日龄35天和42天都有增加(图5A)。第42天,第4组(对照组)的血清Ig G水平显著高于第1、2和3组(图5A)。所有组的P[5] 特异性Ig G水平在出生后下降,在第28天达到基线(血清稀释度1:200)(图5B)。与G6特异性Ig G水平相同,P[5]特异性Ig G水平在第35天和第42天有所增加(图5B)。
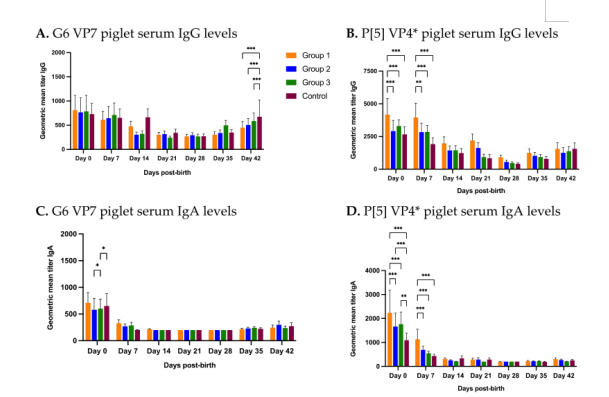
图5各个时间点仔猪血清中C群轮状病毒特异性抗体水平。返饲3次(组1)、2次(组2)、1次(组3)或不返饲(组4)的后备母猪所生仔猪血清中C群轮状病毒特异性Ig G和Ig A抗体水平随时间的变化。后备母猪在第0(F)周产仔。(A)G6 VP7特异性Ig G抗体水平,(B)P[5]截短蛋白VP4*特异性Ig G抗体水平,(C)G6 VP7 特异性IgA抗体水平,(D)P[5]截短蛋白VP4*特异性IgA抗体水平。横轴代表多个样本采集时间点(−5W=产前5周;−3W=产前3周;F=分娩时;+3W=产后3周或断奶时)。纵轴代表各个组抗体的几何平均值 (*p<0.30;**p<0.002;*p<0.001)。
在出生时,第1组仔猪血清中G6特异性IgA抗体水平高于所有其他组,但差异不显著(图5C),第2组的IgA水平与第3组相比有显著差异,第3组的IgA水平与对照组有显著差异(图5C)。总体而言,所有组的仔猪血清中G6特异性IgA水平在出生时最高,在第7天迅速下降,随后达到基线(1:200)。出生时,第1组P[5]特异性Ig A水平(几何平均值 2235.38)显著高于第2组(几何平均值 1665.28)、第3组(几何平均值 1766.54)和对照组(几何平均值 1090.19)(图5D)。有趣的是,第1组P[5]特异性IgA水平在第7天仍显著高于其他试验组(图5D)。断奶后G6和P[5]特异性 IgA水平较IgG水平略有上升(图5A-D)。
3.3 初乳中C群轮状病毒抗体水平低于A群轮状病毒
本研究中后备母猪的返饲材料也含有A群轮状病毒。对经产母猪初乳/常乳中A群轮状病毒(G4、G5、P[7]和P[23])特异性抗体反应已在其他地方进行了讨论。本节对分娩时初乳中A群轮状病毒和C群轮状病毒抗体水平进行了归纳。在所有4个试验组中,无论G型和P型,初乳中C群轮状病毒特异性Ig G和Ig A水平均低于A群轮状病毒抗体水平(图6A-D)。所有4组的G4/G5基因型 A群轮状病毒特异性Ig G和Ig A水平均在数值上高于G6 基因型C群轮状病毒特异性抗体水平(图6A-D)。P[7]和P[23]基因型A群轮状病毒特异性抗体水平显著或在数值上高于P[5]基因型C群轮状病毒抗体水平(图6A-D)。第1组P[7]和P[23]基因型A群轮状病毒特异性IgA抗体水平显著高于P[5]基因型C群轮状病毒特异性 IgA水平(图6A)。在第2组中,P[7]基因型A群轮状病毒特异性Ig G水平显著高于P[5]基因型C群轮状病毒 特异性Ig G水平(图6B)。第3组的P[7]和P[23]基因型A群轮状病毒特异性 IgA水平显著高于P[5]基因型C群轮状病毒,IgG水平数值上高于P[5]基因型C群轮状病毒(图6C)。对照组P型A群轮状病毒特异性Ig G和Ig A水平均在数值上高于P[5]基因型C群轮状病毒(图6D)。在所有4组中,截短蛋白VP4*(P基因型特异性) IgG和IgA水平均数倍高于VP7(G基因型特异性)抗体水平(图6A-D)。
3.4. 仔猪出生时血清中C群轮状病毒抗体低于A群轮状病毒
仔猪血清中特定的A群轮状病毒(G4、G5、P[7]和P[23])抗体水平已在其他地方讨论过。除对照组P[5]C群轮状病毒 Ig G水平高于P[23]A群轮状病毒外,其余各组仔猪血清C群轮状病毒 Ig G和Ig A水平均低于A群轮状病毒水平(图7A-D)。第1组和第2组出生时的P[7]和P[23]基因型A群轮状病毒特异性Ig G和Ig A水平显著高于P[5]基因型C群轮状病毒抗体水平(图7A,B)。G4和G5基因型 A群轮状病毒特异性抗体水平显著或在数值上高于G6 基因型C群轮状病毒抗体水平(图7A-D)。重要的是,对照组P[7]和P[23]基因型A群轮状病毒特异性 IgA水平显著高于P[5]基因型C群轮状病毒特异性 IgA水平(图7D)。P[7]基因型A群轮状病毒特异性Ig G水平也显著高于P[5]基因型C群轮状病毒特异性 Ig A水平。P[23]基因型A群轮状病毒和P[5]基因型C群轮状病毒的 Ig G水平之间无显著差异(图7D)。
3.5 仔猪C群轮状病毒排毒与抗体应答
后备母猪返饲材料含有A群和C群轮状病毒毒株。对第1次(产前5 周)、第2次(产前4周)和第三次3(产前5 周)返饲材料用实时荧光定量PCR检测,显示C群轮状病毒的 ct值分别为32.55、29.32和30.30。相反,第1次(产前5 周)、第2次(产前4周)和第三次3(产前5 周)返饲材料中A群轮状病毒 ct较低,分别为24.42、22.46和24.15。先前已详细描述了后备母猪和仔猪C群轮状病毒排毒情况,并在补充表S1中进行了总结。不出所料,产仔后24小时内采集的仔猪粪便拭子经qRT-PCR检测为C群轮状病毒阴性。所有组在第7天才开始排毒,但仅在对照组仔猪中观察到C群轮状病毒的高病毒载量(低ct值)(补充表S1)。有几窝仔猪在断奶前(第21天之前)开始排毒。在第7天首次检测到C群轮状病毒时,对照组母猪所产仔猪排毒窝数为最高(58%),而第1、2和3组排毒窝数分别有17%、42%和9%。在第4组(对照组)中,第7天C群轮状病毒排毒窝数多和病毒载量高与初乳中G6特异性和P[5]特异性IgA抗体水平相关。尽管出生时所有组仔猪血清中的G6基因型 C群轮状病毒特异性IgA水平都在接近范围内(图5C),但与3个试验组相比,对照组的仔猪血清中P[5]基因型特异性IgA水平最低(图5D)。第7天仔猪血清抗体水平显示,以窝来计,P[5]特异性IgA水平低于800的仔猪跟C群轮状排毒显著相关。
3.6 返饲材料和仔猪粪便中C群轮状病毒的序列分析
断奶前采集来自4个试验组的30个粪便样品,代表断奶前C群轮状病毒的排毒情况,对分离毒株进行测序来研究乳源性免疫力压力下的病毒变异。结果只能从试验组2、3和对照组仔猪的11个粪便样本中获得完整的C群轮状病毒基因组(表2)。测序结果显示,所有11个样本的C群轮状病毒基因组分型均为G6-P[5]-I5-R1-C1-M1-A1-N6-Tu-Eu-H1,与排毒时间(1、2或3周)无关。在这11个样品中检测到的G和P型组合(G6P[5])与返饲材料中存在的C群轮状病毒基因型(G6,P[5])相似。序列分析表明,来自仔猪粪便的11个G6基因型 VP7序列与后备母猪返饲的G6毒株具有很高的核苷酸(98.62-99.90%)同源性和氨基酸(98.22-100%)同源性。6个G6序列与G6 返饲毒株完全匹配。为了确定基因变异,将从仔猪粪便中回收的11个G6序列的中和表位与返饲毒株G6株进行比较。5个G6基因序列在245-247位氨基酸发生缺失,与返饲毒株G6株在248位氨基酸(L248I)也存在差异(表3)。来自仔猪的其他6个G6序列与返饲毒株G6株完全匹配。同样,来自仔猪粪便的P[5]VP4序列与返饲材料中P[5]毒株的核苷酸(99.09-100%)和氨基酸(99.11%)有很高的同源性。仔猪VP4基因与返饲毒株P[5]基因型C群轮状病毒株在41(T41I)、203(I203L)、262(R262W)和350(G350D)氨基酸序列上存在差异。
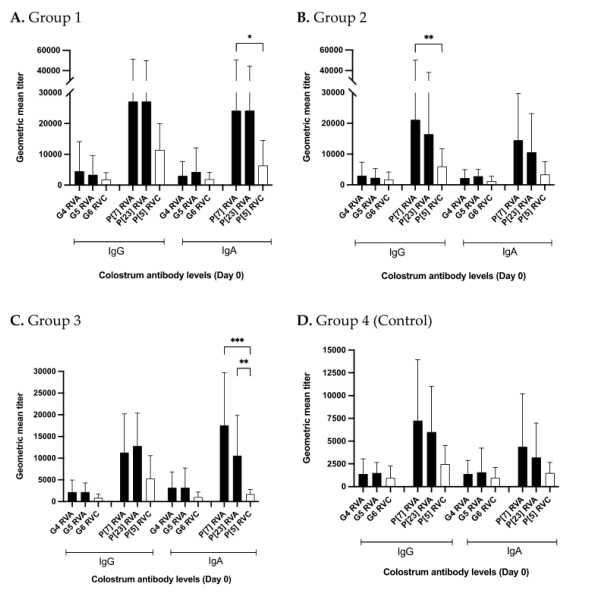
图6 各试验组间初乳(第0天)中A群和C群轮状病毒特异性抗体水平的比较。纵轴代表各试验组的几何平均抗体水平。横轴代表A群和C群轮状病毒基因型特异性Ig G和Ig A抗体水平。黑色阴影条表示不同的A群轮状病毒基因型,白色条表示不同的C群轮状病毒基因型。(A)第1组A群和C群轮状病毒抗体水平;(B)第2组A群和C群轮状病毒抗体水平;(C)第3组A群和C群轮状病毒抗体水平;(D)第4组(对照组)A群和C群轮状病毒抗体水平。显着性水平(p值)仅描述A群和C群轮状病毒之间的比较(*p<0.30;**p<0.002;*p<0.001)。
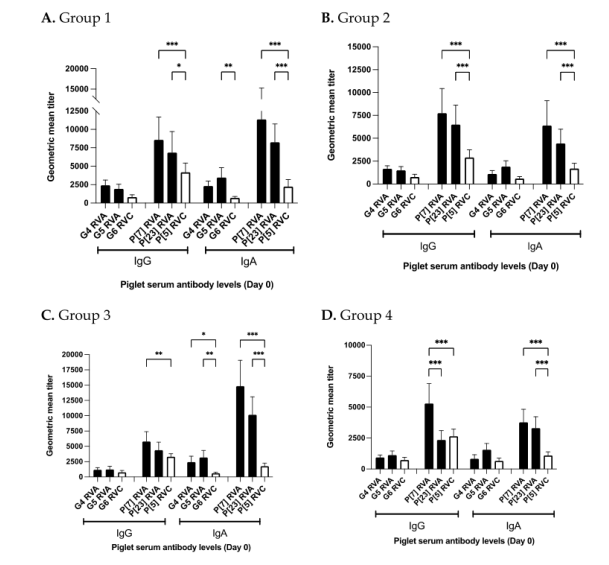
图7各试验组间仔猪血清(第0天)中A群和C群轮状病毒特异性抗体水平的比较。纵轴代表各试验组的几何平均抗体水平。横轴代表A群和C群轮状病毒基因型特异性Ig G和Ig A抗体水平。黑色阴影条表示不同的A群轮状病毒基因型,白色条表示不同的C群轮状病毒基因型。(A)第1组A群和C群轮状病毒抗体水平;(B)第2组A群和C群轮状病毒抗体水平;(C)第3组A群和C群轮状病毒抗体水平;(D)第4组(对照组)A群和C群轮状病毒抗体水平。显着性水平(p值)仅描述A群和C群轮状病毒之间的比较(*p<0.30;**p<0.002;*p<0.001)。
4、讨论
目前,返饲是唯一经济有效的诱导母源抗体以被动保护仔猪免受C群轮状病毒感染的方法。然而,由于缺乏检测C群轮状病毒抗体的血清学工具,返饲方案的有效性尚未得到评估。为了填补这一知识空白,我们优化了VP7(G6)和截短蛋白VP4*(P[5])的特异性间接ELISA,并研究了返饲的后备母猪对C群轮状病毒的抗体反应和仔猪获得的被动免疫力。据我们所知,这是第一次在多个时间点调查后备母猪/经产母猪(产仔前和产后血清)、初乳/常乳及其仔猪中C群轮状病毒抗体水平的纵向研究。
后备母猪产前三周,第1组完成2次返饲,第2组和第3组完成1次返饲,其血清中的Ig G和Ig A水平升高,反映了后备母猪对C群轮状病毒产生了主动免疫。分娩母猪血清抗体水平下降,表明C群轮状病毒特异性抗体由血转移到了初乳。与血清Ig A水平相比,母猪血清Ig G水平的下降更为数值上高于(图2A-D)。母猪分娩时A群轮状病毒抗体水平也有类似的趋势。这种差异的可能原因可能是乳腺实质中合成的IgA释放到后备母猪/经产母猪血清中,或者血清IgA到外分泌液中的转运减少了。一项研究发现,母猪血清中A群轮状病毒IgA水平在妊娠的最后几周升高,而血清中的Ig G水平在分娩时急剧下降。然而,分娩时血清Ig G和IgA水平的差异可能并不能真正反映它们在初乳中的水平,因为初乳中只有24-54%的IgA来自血清,而所有的初乳Ig G都来自猪的血清。
由于母猪在怀孕期间抗体不能通过胎盘屏障,因此小猪出生时体内没有抗体,而通过初乳/常乳的摄取来获得特定病原体的抗体对它们的生存至关重要。我们发现第1组初乳中(第0天)Ig G和Ig A抗体水平显著或者数值上高于高于其他组,这表明在分娩前给第1组母猪完成3次返饲比其他次数的返饲能更好地诱导母源免疫力。此外,对照组(无返饲组)初乳抗体水平最低,导致7日龄仔猪C群轮状病毒排毒率最高(58%),而第1、2和3组仔猪的排毒率分别为17%、42%和9%。相较于初乳,7日龄常乳中的Ig G水平速下降,伴随着从分娩至断奶期间后备母猪血清Ig G水平迅速上升。相反,常乳中的IgA水平在第7天至第21天稳步上升,这表明乳房局部产生的C群轮状病毒特异性IgA增加,随后乳汁中的分泌量也增加。多种基因型的A群轮状病毒返饲母猪后,其初乳/常乳中的Ig G和Ig A抗体的变化也有类似规律。例如,与其他组相比,3次返饲的第1组后备母猪的C群轮状病毒和A群轮状病毒特异性Ig G和Ig A水平均较高。
有关对猪C群轮状病毒的母源抗体保护的数据非常罕见,大多数猪轮状病毒母源抗体的研究都是针对A群轮状病毒。最近,利用基于基因型特异性和多种基因型特异性病毒样颗粒(VLP)的间接ELISA方法,检测了母猪乳汁和血清样本中的C群轮状病毒抗体水平。作者报道了分娩2-11天后采集的乳汁中针对C群轮状病毒 G6基因型的Ig G和Ig A水平没有差异。与Chepngeno的研究类似,我们还观察到对照组后备母猪(无返饲)在分娩时初乳样本中具有水平相近的C群轮状病毒G6基因型特异性Ig G和Ig A水平。比较初乳中(第0天)A群和C群轮状病毒的抗体水平发现,对于所有4个试验组,无论G型和P型,抗C群轮状病毒抗体水平都(显著或数值上高于)低于A群轮状病毒水平。初乳中对A群和C群轮状病毒抗体水平的差异可能是由于后备母猪中两群病毒复制能力的差异,产仔前后备母猪排毒水平的差异支持这一点。对于A群轮状病毒,试验组第一次返饲导致71.4%(25/35)的后备母猪在产仔前4.5周时排毒,而C群轮状病毒在第一次返饲后,仅有20%(7/35)的后备母猪排毒。总体而言,与C群轮状病毒相比,A群轮状病毒返饲的后备母猪会有更高比例的排毒。
第1组第0天和第7天仔猪血清中P[5]特异性IgA水平很高反映了第1组初乳中P[5]特异性IgA水平很高,说明3次返饲C群轮状病毒诱导的抗体反应比其他返饲次数略有增强。但各组仔猪第0天血清中G6特异性 Ig G水平无显著差异,各组的G6 特异性Ig A水平也在一个较窄的范围内。在出生仔猪第0天血清中,针对A群和C群轮状病毒的抗体水平也有显著差异(图7A-D)。重要的是,无论G型和P型,出生猪第0天血清中的C群轮状病毒 IgA水平都显著低于A群轮状病毒水平(图7A-D)。我们推测,返饲材料中C群轮状病毒的ct值(ct值32.55、29.32和30.30)高于A群轮状病毒(ct24.43、22.46和24.15),不能诱导足够的免疫力,导致初乳C群轮状病毒抗体水平较低。在产房中,低水平的C群轮状病毒抗体不能被动地保护仔猪免受自然C群轮状病毒感染。来自仔猪的轮状病毒排毒数据也支持这一假设。在断奶前,A群轮状病毒组只有两窝(5.8%,2/34)仔猪排毒,而C群轮状病毒组在第7天,有8窝仔猪(23.5%,8/34),第14天和第21天,有18窝仔猪(53%,18/34)排毒(补充表S1)。产房A群轮状病毒排毒极少,提示返饲A群轮状病毒诱导了更好的被动免疫,其返饲材料中的ct值低于C群轮状病毒。
已知后备母猪的低C群轮状病毒抗体水平与仔猪较高的临床发病率有关。我们还发现,在P[5]特异性IgA抗体几何平均值 几何平均值<800的仔猪中,与C群轮状病毒阳性的仔猪呈正相关。有趣的是,我们观察到对照组出生仔猪第0天血清P[7]和P[23]特异性A群轮状病毒 IgA水平显著高于P[5]特异性C群轮状病毒 IgA水平(图7D)。这一发现意义重大,因为对照组后备母猪没有接受产前返饲。对照组仔猪出生时较高的抗A群轮状病毒 IgA水平表明,在不给后备母猪返饲的情况下,对A群轮状病毒的被动免疫力高于C群轮状病毒。这一发现反映了在没有返饲的情况下后备母猪和仔猪的轮状病毒A和C群轮状病毒抗体反应的差异性。
二代测序在断奶前仔猪粪便样本中检测到G6P[5]的G和P型组合,这与后备母猪的原始返饲材料中存在的C群轮状病毒基因(G6,P[5])相似。此外,来自仔猪的C群轮状病毒各毒株之间的核苷酸和氨基酸同源性很高和点突变极少,这些都再次证明了C群轮状病毒 返饲诱导的母源抗体不足以防止仔猪在产房感染C群轮状病毒。相反,我们早些时候在两个断奶前样本中发现了A群轮状病毒的G和P型组合(G11P[34]),这与后备母猪原始返饲材料中存在的G4、G5、P[7]和P[23]基因型不同。轮状病毒的VP7和VP4蛋白独立地激发中和和保护性抗体反应。我们观察到蛋白截短体VP4*诱导的C群轮状病毒 Ig G和Ig A水平高于VP7,这可能是由于VP4上存在比VP7更多的中和表位。同样地,我们早些时候已经观察到针对轮状病毒A的蛋白截短体VP4*抗体水平也高于VP7抗体水平。
综上所述,第1组产前完成3次返饲后,初乳中的抗C群轮状病毒抗体水平显著升高。虽然3次返饲都能较好地诱导母源抗体,但所有返饲次数都不能阻止产房仔猪C群轮状病毒的排毒,这反映了返饲材料中C群轮状病毒载量较低(ct值较高)。我们的结果表明,后备母猪初乳和仔猪血清中C群轮状病毒抗体水平显著低于A群轮状病毒,这可能是新生仔猪C群轮状病毒感染率较高的原因。由于轮状病毒A在猪场中更为普遍,而且后备母猪通常的A群轮状病毒抗体水平比C群轮状病毒抗体水平更高,因此建议在分娩前5、4和3周只给后备母猪完成C群轮状病毒返饲(不含A群轮状病毒)。此外,还需要更多的研究来寻找增加返饲材料中C群轮状病毒病毒载量的方法。这项研究的结果改变了我们对猪C群轮状病毒抗体反应的低估,以及返饲在为天生阴性的仔猪提供乳源性免疫力的作用。