
最近天康制药技术服务团队在驻场服务多个病毒性腹泻的集团猪场发现:同一猪场甚至同一头腹泻仔猪上有着2种或者3种不同的轮状病毒。惊叹之余,我们查阅了相关资料,证实了这个发现不是一个偶然现象,而可能是猪群感染轮状病毒的普遍规律。为此,我们本期跟大家分享一篇苏黎世大学兽医学院病毒学研究所Bachofen教授等人2022年发表的文章《瑞士猪群频繁发生多种轮状病毒的同时感染》。
本文主要观点:
(1)轮状病毒可以单独发生,也可以在多个轮状病毒种型的混合感染。猪经常同时感染多种轮状病毒。多种型轮状病毒的同时感染与腹泻相关,并可能加剧临床症状。然而,在没有临床症状的仔猪中也发现了混合感染。
(2)断奶是轮状病毒排毒增加的主要触发因素,断奶过程可能不仅促进了多个轮状病毒亚群的同时感染,而且也促进了同一亚群的多个毒株的同时感染。多重轮状病毒A群毒株感染的猪也同时感染了轮状病毒C群和B群毒株,猪只都是5 - 6周龄左右,出现腹泻和消瘦。多个毒株的同时感染可能比想象的发生得更频繁,可能包括多达四种不同的轮状病毒A群毒株。
(3)在非洲和台湾的人粪便样本中已经发现了多种轮状病毒毒株的感染,并被推定为导致疫苗效率降低的原因之一。在美国广泛使用的轮状病毒A群活疫苗可能促进轮状病毒A型多样性并引起多重感染。
(4)确定影响断奶后轮状病毒易感性的因素不仅可以降低轮状病毒腹泻造成的损失和新的重组产生的风险,还可以在腹泻问题时减少不必要的抗生素治疗。
Frequent Occurrence of Simultaneous Infection with Multiple Rotaviruses in Swiss Pigs
瑞士猪群频繁发生多种轮状病毒的同时感染
原文链接:
https://doi.org/10.3390/v14051117
摘要
轮状病毒(RV)感染是瑞士仔猪腹泻最重要的病毒原因,对养猪业造成重大经济损失。然而,目前还没有关于感染猪的主要轮状病毒(轮状病毒A群、B群和轮状病毒C群毒株)的发生和动态情况以及流行毒株的基因多样性的研究。因此,我们对来自横断面采样(n = 95)和纵向时间轴采样(n = 48)的粪便样品用RT-PCR检测轮状病毒A群、B群和轮状病毒C群毒株,并将横断面采样结果与尸检结果进行比较。此外,对8个样本用下一代测序技术进行了全基因组测序和分型。在横断面研究中,轮状病毒的三重感染与腹泻和消瘦显著相关,且在断奶仔猪组中最常见。在纵向时间轴研究中发现,轮状病毒在断奶后一周达到排毒高峰,随后下降。双重感染(2种轮状病毒同时感染)占比很高,但只有少数猪只出现腹泻。全基因组测序揭示了与其他欧洲国家相似的基因型模式,重要发现是,同时感染涉及的轮状病毒A群毒株高达4种。我们的研究表明,仔猪断奶不仅可能引发轮状病毒排毒,还可能推动同一宿主中多种轮状病毒和多个毒株的共同感染。
关键词
猪轮状病毒、多重感染、基因型、瑞士
1. 简介
轮状病毒属是呼肠孤病毒科的一员,其基因组由11段双链RNA组成,被包裹在一个三层病毒颗粒中。基因组编码6个结构蛋白(VP1-4、VP6和VP7)和5或6个非结构蛋白(NSP1-6)。轮状病毒是与婴幼儿急性肠胃炎相关的最常见病原体之一,在世界各地的人类和猪只中都是如此。特别是在哺乳仔猪和断奶猪中,轮状病毒感染可引起小肠绒毛萎缩,从而导致吸收不良和腹泻。由于生长迟缓和死亡率增加造成经济损失。随着年龄的增长,感染后出现临床症状的可能性降低。然而,腹泻是一种多因素、多病因的疾病,主要是母源抗体保护差和肠道病原体感染压力大共同作用的结果。根据VP6的抗原特性,目前将轮状病毒分为9个群,即A-J群(https://talk.ictvonline.org/taxonomy/,2022年4月8日访问)。然而,最近在德国的鼩鼱中发现了另外两种暂定种型(轮状病毒K群和L群)。在猪中,A群、B群、C群、H群和E群轮状病毒已有报道。轮状病毒A群(RVA)是最最常见的种型,其次是轮状病毒C群(RVC)和轮状病毒B群 (RVB)。
轮状病毒可以单独发生,也可以在多个轮状病毒种型的混合感染。猪经常同时感染多种轮状病毒。混合感染在断奶猪中尤其常见。多种型轮状病毒的同时感染与腹泻相关,并可能加剧临床症状。然而,在没有临床症状的仔猪中也发现了混合感染。除了轮状病毒不同群毒株的混合感染外,还发现了同群轮状病毒不同毒株的混合感染,例如几种轮状病毒A群毒株的同时感染。这些多重感染的临床影响尚不清楚。然而,由于轮状病毒的基因组多个片段的特点,这种混合感染提供了大量的重组机会,并可能产生具有新特性的毒株。轮状病毒A群、B群、C群和H群毒株不仅在猪身上被检测到,在人身上也被检测到。因此,人畜间传播是可能的,并可能导致出现轮状病毒A群毒株的新基因型,如在全球范围人群中出现的G9毒株,被认为是猪向人外溢传播的结果。虽然多种轮状病毒A群毒株的同时感染很重要,但我们对同时感染发生的频率和为何发生知之甚少。基因序列通常来自对PCR产物的桑格测序,一种只产生一个显性序列或多个核苷酸的混合序列的不完美的方法。下一代测序(NGS)可以通过PCR产物的目标区域测序或对样本材料的直接宏基因组测序来克服这一问题。
传统上,轮状病毒毒株只使用两个外衣壳蛋白VP7和VP4进行分类,分别定义G(糖蛋白)和P(蛋白酶敏感)基因型。到目前为止,轮状病毒A群至少有41种G型和57种P型被报道。(https://rega.kuleuven.be/cev/viralmetagenomics/virus-classification/rcwg,于2022年2月13日访问)。2008年,基于轮状病毒A群毒株11个基因片段序列数据的扩展全基因组序列分类系统被提出。
对于每个片段(VP7-VP4-VP6-VP1-VP2-VP3-NSP1-NSP2-NSP3-NSP4-NSP5),可以分配一个特定的基因型范围,用字母(G-P-I-R-C-M-A-N-T-E-H)和数字表示,例如,A1-24表示NSP1。流行毒株的基因型可以影响人轮状病毒疫苗的有效性,因为对与疫苗毒株具有不同P/G基因型的流行毒株而言,疫苗产生的中和抗体不容易中和它们。此外,全基因组基因分型可能揭示VP7和VP4以外的基因组片段的物种起源,从而揭示之前的种间传播。
关于在瑞士流行的轮状病毒毒株的数据很少。2010年在瑞士两家医院检查的儿童中,发现了G1-4、G9和P,但没有关于猪轮状病毒毒株的数据。在瑞士,猪的健康状况与其他欧洲国家相比是高的。在没有如猪繁殖呼吸综合征病毒(PRRSV)和传染性胃肠炎病毒(TGEV)等重要的猪传染病的情况下,轮状病毒被认为是瑞士仔猪腹泻最重要的病毒病原(https://www.blv.admin.ch/blv/de/home/tiere/tiergesundheit/frueherkennung/pathopig.ht,于2022年4月8日访问)。然而,目前尚不清楚瑞士猪群中轮状病毒的动态构成和存在的基因型。因此,本研究的目的是首次获得有关轮状病毒A群、B群和C群毒株的流行情况、不同年龄组猪只轮状病毒的混合感染的动态以及瑞士猪中流行的轮状病毒A群毒株的基因多样性等方面的数据。结果表明,瑞士猪轮状病毒的基因多样性较高,其基因型种类和欧洲其他国家的类似,这是其他猪病毒不同的特点。此外,轮状病毒的混合感染似乎是频繁的,并且可能由于断奶引发。
2. 材料与方法
2.1. 样品
2.1.1. 横断面研究
保存在-20℃的猪粪便样本和安乐死后马上用福尔马林固定的猪肠道样本由苏黎世大学兽医病理研究所提供。这些样本来自通过“PathoPig”系统提交尸检的猪只。瑞士联邦食品安全和兽医办公室于2014年启动了该项目,通过资助对有健康问题的猪群进行死后分析,改善猪只健康。总的来说,我们研究了2018年至2020年期间收集的来自55个猪场的95头猪的单独采样,包括31头哺乳仔猪、37头断奶猪和27头育肥猪。其中猪69头有腹泻,26头没有腹泻。入选标准是在安乐死后1小时内进行福尔马林固定的肠道样本,肠道形态保持完好,特别是空肠浅表肠细胞。
2.1.2. 纵向研究
在一项未发表关于氧化锌吸收(一种传统饲料添加剂,在瑞士只允许在非常有限的浓度下使用)的初步研究中,来自同一猪场的5窝猪仔从4周断奶跟踪到第9周,对轮状病毒进行了回顾性分析。据了解,轮状病毒在这个小型养猪场长期存在,但没有报告腹泻问题的增加。该猪场断奶后一直没有发现任何特定的肠道病原体。第一批样本是母、仔猪分开之前采集。在这个时间点上,分别从每头小猪和五头母猪身上采集粪便样本。如前所述,从空的断奶栏和母猪栏的地板上采集猪圈地板样品。在研究过程中,仔猪逐头打耳标记来识别。然后将48头仔猪平均分配到两个断奶圈中,每周从直肠采集粪便样本(第7周除外),并对仔猪进行临床检查来评估腹泻症状。第6周后,围栏变得太小了,20只猪从研究中移除。由于与研究无关的原因,1只猪在第5到6周期间被安乐死,另1只在第8周后被安乐死。样品保存在-20℃,直到进一步处理。
2.2. 尸检分析
横断面研究的样本按猪的年龄分类:哺乳仔猪(0.4 -<5周),断奶猪(5 -<10周)和肥猪(10 -36周)。除了年龄外,还评估了可能与轮状病毒感染有关的尸检发现,如腹泻、肠绒毛消瘦和缩短。由病理学家对腹泻有无进行感官判定,判为“是”或“否”。为了判定消瘦的程度,在尸检前称重,并与各年龄组的预期体重进行比较,预期体重基于文献报道和病理学家的经验。如果实际体重是预期体重的2/3,则判为消瘦。常规处理固定后的肠段,用石蜡包埋,按5 μ m厚切片,然后用苏木精和伊红染色,由兽医病理研究所的病理学家用光镜测量绒毛高度和隐窝深度。正常情况下,小于1周龄的乳猪的绒毛高度-隐窝深度比(VCR)最小值为7.5:1,1 - 4周龄的仔猪的绒毛高度-隐窝深度比(VCR)最小值为2.5:1,大于10周龄的仔猪的绒毛高度-隐窝深度比(VCR)最小值为2:1。如果VCR低于这个比例,绒毛萎缩程度进一步分为轻度、中度或重度。组织学评估的例子在补充图S1中展示。
2.3. RNA提取
2.3.1. 病毒RNA试剂盒
为了获得后续实时RT-PCR所需的RNA,粪便样本被解冻并充分混合。在2ml 离心管中称量100 mg粪便,加入1000 μ L PBS。随后,样品在组织研磨机中以20 Hz的频率匀浆1分钟,然后以16.000× g离心3分钟。根据制造商手册,使用病毒RNA小试剂盒除去产生的上清进行RNA提取,但省略了载体RNA的添加。洗脱步骤使用50µl的无核酸酶水。对于每一批RNA提取,都包括一个阴性提取对照,用水代替粪便。RNA存储在-20℃,直到进一步处理。
2.3.2. 酚-氯仿法提取RNA
苯酚-氯仿法用于制备后续下一代测序所需的RNA。简单地说,在2ml试管中,将1ml RNA提取缓冲液(0.5%NP-40, 150 mM NaCl, 1.5 mM MgCl2和10 mM Tris-HCL, pH 7.4)加入到400 mg混合良好的解冻粪便样本中。样品在组织研磨机中以20 Hz匀浆30 s,在16.000× g离心1分钟后,将500 L的上清转移到新的2ml管中。然后加入500µL的酸酚-氯仿-异戊醇(125:24:1, pH 4.5) ,样品在16.000× g下旋转20 s,离心15 min。小心地去除水相,转移到新的2ml管中。再次加入500 μ L酸酚-氯仿-异戊醇,重复上述步骤。在加入50µL醋酸钠(3 M, pH 5.2,蒸压),3µL超纯糖原(20µg/µL)和1 mL 100%乙醇后,旋转管,在-80℃下孵育30分钟,并在16.000× g下4℃下离心30分钟,使RNA沉淀。沉淀用1 mL 75%乙醇洗涤一次,在层流工作台上干燥,用60µL无核酸酶水重新悬浮 RNA。RNA存储在-20℃,直到进一步处理。
2.4多重实时RT-PCR检测
所有样本分别进行轮状病毒A群、B群和C群的检测。对于轮状病毒A群的检测,我们参考了制造商手册,将商用猪肠道传染性胃肠炎病毒/流行性腹泻病毒/轮状病毒A型试剂盒与多重一步法RT-PCR试剂盒一起使用。该试剂盒可同时识别轮状病毒A群、猪流行性腹泻病毒和传染性胃肠炎病毒。对于轮状病毒B群和C群的检测,使用多重一步法RT-PCR试剂盒与Marthaler等人报道的引物和探针。反应在实时PCR系统应用生物上进行。达到DNA指数级扩增所需的扩增周期数(Ct值)被当做初始RNA水平的半定量指标。简而言之,Ct值越低,说明测试材料中RNA越多。
2.5下一代测序(NGS)和基因分型
横断面研究中Ct值为小于33且有足够样本量的轮状病毒A型阳性样本进行下一代测序以确定全基因组。此外,从先前的戊型肝炎病毒研究中提取的两个猪圈地板拭子样本也被纳入其中,得到29个样本。使用苯酚-氯仿法提取RNA后,按照库巴茨基等人建立的内部协议进行反转录、第二链合成和扩增。随后,用荧光计测量DNA浓度。随后,样品用EB缓冲液稀释至最终浓度为3 ng(58µL),使用E220聚焦超声仪将DNA裂解至500碱基对(bp)。根据制造商的说明书,使用DNA文库准备试剂盒制备文库。NovaSeq 6000用于苏黎世功能基因组学中心(FGCZ)的双端测序,读取长度为150 bp。Phi X控制v3文库是用作质量控制。生成的序列在之前建立的从头和参考导向装配管道中进行了质量检查和分析。简而言之,使用metaspades (v3.12.0)组装质量检查读,使用blastn (v2.8.1+)与NCBI非冗余数据库进行比较,重新生成的重叠群 (https://blast.ncbi.nlm.nih.gov/Blast, 2021年12月11日访问),使用最佳blastn命中进行注释,并使用bwa (v0.7.17) mem (https://github.com/lh3/bwa, 2021年12月11日访问)映射回组装序列。使用具有高严格设置的SeqMan NGen 17软件使用500核苷酸(nt)长度的从头组合进行基于参考的重组为了确定匹配读取的数量和视觉上控制对齐。
使用在线轮状病毒A型基因分型工具RotaC进行基因分型(2021年12月11日:https://www.viprbrc.org/)。它遵循全基因组的指导方针轮状病毒分类工作组(RCWG)推荐的轮状病毒A型基因分型。所有全基因分型序列上传到GenBank(访问编号为OM982707-OM982822;详情载于补充表S1), 并将相应的NGS原始数据提交给SRA(生物样本SAMN26634154-SAMN26634161)。
2.6. 系统进化分析
对覆盖95%以上的所有片段的全长和近完全编码序列(CDSs)进行系统进化分析,使用MEGA X软件计算最佳拟合模型。利用具有不变点的离散伽马分布的一般时间可逆模型,构建了具有500个自举点的最大似然树。对于每个序列,根据BLAST分析从NCBI轮状病毒序列数据库中下载完整的CDS参考基因组,其中包括各自基因型中与猪和人类起源(数据库报告为“宿主”)最密切相关的三个序列。在某些情况下,其他猪只宿主的密切相关序列也被包括在内。此外,包括三个主要猪参考毒株(OSU、Gottfried、YM)的所有片段,以及代表两个主要轮状病毒A型基因组的两个人类分离株Wa和SD-1。在代表次要基因群的AU-1参考毒株中,只使用了VP4和VP7序列。作为欧洲猪轮状病毒A型的代表,我们添加了五个特征良好的比利时毒株的所有片段:1977年的VR277和2012年的12R002、-005、-006和-041。
2.7. 统计分析
统计分析使用NCSS 10统计软件。p值低于0.05被认为显著。为了比较因轮状病毒物种数量增加而感染的猪只与尸检结果或年龄组的比例,我们计算了列联表,然后用卡方检验进行两两比较。
3. 结果
3.1. 横断面研究
对31头哺乳猪、37头断奶猪和27头育肥猪的95份样品进行轮状病毒A群(包括传染性胃肠炎病毒和流行性腹泻病毒)、轮状病毒B群和轮状病毒C群检测。这些猪只的年龄范围在刚出生到36周之间,其中50%的猪只年龄在5到10周之间。所有猪传染性胃肠炎病毒和流行性腹泻病毒均为阴性。只有10只猪(11%)对所有轮状病毒呈阴性,而18只猪只(19%)感染了单一轮状病毒种型。大多数猪只对2种(n = 33, 35%)或3种(n = 34, 36%) 轮状病毒呈阳性(图1)。轮状病毒阴性猪只主要属于育肥猪年龄组(10只猪只中有6只),3只猪只是哺乳仔猪,只有一只断奶猪对所有轮状病毒种型呈阴性(图1a)。相反,轮状病毒双重或三重感染的猪只以断奶猪为主,分别为48%和56%。有趣的是,单一感染主要发生在哺乳仔猪中(78%)。然而,由于一些群体的猪只数量少于5只,因此不可能进行可靠的统计分析。总的来说,69只猪(73%)出现腹泻。随着(共同)感染轮状病毒种型数量的增加,腹泻猪只的比例从轮状病毒阴性猪只的50%增加到三重感染病例的91%(图1b)。三重感染的猪发生腹泻的频率明显高于阴性、单一感染和双重感染的猪。消瘦的情况也有上述规律。在42头参加评估的猪只中,体重低于预期体重的猪只约占2/3。然而,只有三重感染和单一感染之间的差异具有统计学意义,65%的三重感染猪和只有17%的单一感染猪出现消瘦(图1c)。至于各年龄组的差异,由于群体规模小于5,阴性、单一感染、双重感染和三重感染猪只的萎缩程度无法进行统计比较。然而,在轮状病毒阴性的猪只中没有观察到严重的绒毛缩短,严重绒毛缩短的猪数量随着同时感染轮状病毒种类数量的增加而逐步增加,其中在轮状病毒三重感染的猪中比例最高(26%)(图1d)。

在67例(71%)病例中,猪显示了几种轮状病毒种型的共同感染。最常见的是轮状病毒A型、轮状病毒B型和轮状病毒C型的三重感染(36%)和轮状病毒A型和轮状病毒C型的双重感染 (25%)。没有观察到单一的轮状病毒B型感染,轮状病毒B型和轮状病毒C型的双重感染以及单一的轮状病毒C型感染也是罕见的(分别为5%和3%)。有趣的是,单一轮状病毒A型感染明显在哺乳仔猪(12只)中占主导地位,但在断奶猪和育肥猪(分别为1只和2只)中罕见(图2)。相反,在断奶猪中,三重感染和轮状病毒A型和轮状病毒C型的双重感染是普遍的。虽然群体规模往往太小,无法在不同类型(共同)感染之间进行统计比较,但当仅使用轮状病毒A型、轮状病毒B型和轮状病毒C型的实时RT-PCR总体结果(独立于共同感染物种)时,他们已经足够大了。轮状病毒C型在断奶猪中明显高于哺乳仔猪和育肥猪,而轮状病毒B型在断奶猪中明显高于哺乳仔猪(图2)。轮状病毒A型在所有年龄组中都很常见,在断奶和育肥猪中主要是与其他轮状病毒种型共同感染,因此在不同年龄组之间没有显著差异。

3.2纵向研究
在出生后第4周,当5窝48头哺乳仔猪断奶时,52%的猪对所有轮状病毒种类阴性。另一半主要是轮状病毒A群整体阳性(40%),其次是轮状病毒C群(29%),只有少部分轮状病毒B群阳性(6%)(图3a)。当将整体结果分成不同种类的轮状病毒的(共同)感染时,轮状病毒A群和C群的共同感染最常见(23%),其次是轮状病毒A群的单独感染(13%)。轮状病毒C群和B群的单一感染罕见,各2只(4%),1只猪有轮状病毒A群和B群的双重感染,未观察到三重感染。在第5周,所有猪的轮状病毒A群和C群总体呈阳性,但没有一只是单一感染。92%的猪是轮状病毒A群和C群的双重感染,8%的猪有三重感染。在接下来的几周内,所有猪的轮状病毒A群总体保持阳性,但轮状病毒A群和C群双重感染的百分比下降,而轮状病毒A群的单一感染的百分比上升。除第4周外,整个研究过程中均未发现轮状病毒B群和C群的单一感染,也未发现两者的共同感染。综上所述,在第4周,双重感染已经很频繁,并在第5周和第6周成为主要的感染类型,但在第6周后下降,单一感染再次增加(图3b)。与横断面研究中三重感染占主导地位相比,本研究中三重感染发生率较低。它们在第5周出现,在第6周达到峰值,但从未在超过15%的猪身上发现。
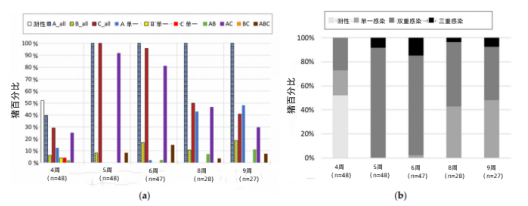
第4周仔猪断奶时对5头母猪和猪圈地板进行取样。母猪粪样轮状病毒A型和轮状病毒B型均为阴性,但有2头母猪轮状病毒C型呈弱阳性。相比之下,5个包含仔猪粪便的猪圈地板样本均为轮状病毒A型弱阳性:2个仅为轮状病毒A型阳性;2个为轮状病毒A型和轮状病毒C型两种阳性;1个是轮状病毒A型、轮状病毒B型和轮状病毒C型三种阳性。在仔猪被放置在断奶栏之前,两个断奶栏都是轮状病毒A群弱阳性。
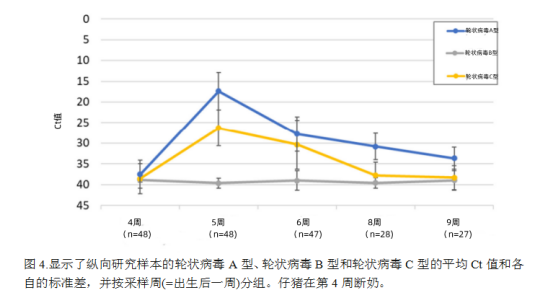
不仅轮状病毒阳性猪只的百分比在断奶后急剧增加,而且检测到的RNA水平也急剧增加(图4)。所有猪只的轮状病毒A群Ct值在断奶后下降(即病毒RNA载量增加),在第5周从15到20不等。在这个峰值之后,RNA水平再次下降,但仍高于第4周的值。所有猪Ct值的变化见补充图S2。轮状病毒C群的情况类似,在第5周观察到一个清晰的峰值,但在所有时间点的平均Ct值仍然低于轮状病毒A群。相比之下,轮状病毒B群在断奶后看不到峰值,病毒RNA载量普遍较低。然而,轮状病毒B群阳性样本的数量也大大低于其他两种轮状病毒种型(图3a)。在收集粪便样本时,也监测了腹泻的存在。第4周无猪出现腹泻。有趣的是,尽管在5周轮状病毒A群和C群 RNA量较高,但只有6头断奶仔猪在采样日出现腹泻:2头出现严重腹泻,4头出现轻度腹泻。在第6周(2头)、第8周(7头)和第9周(3头)猪只也出现轻度腹泻。
3.3轮状病毒毒株的下一代测序和基因分型
为了确定全基因组序列,对横断面研究中的阳性粪便样本中轮状病毒A群Ct值低于33的毒株进行了下一代测序。在入选的29个样本中,有11个样本的任何基因的覆盖率都没有超过50%。在另外10个样本中,大多数基因不符合基因分型标准(即长度>500碱基和>50%的编码序列覆盖率)。在1个样本中,所有基因均可分型,编码序列覆盖范围在60.9%到100%之间(补充表S2)。在其余7个样本中,所有基因都可分型,编码序列覆盖率超过95%。只有满足所有片段基因分型标准的8个样本被纳入进一步分析。这8个样本产生的总读数在8.4到25.4 Mio之间;与各毒株匹配的读数的绝对数(将每个基因匹配的读数相加)在13.434 ~ 2.2 Mio之间,相对匹配读数分别为0.08%和8.5%(补充表S2)。虽然相对读数最低的样本也具有最低的轮状病毒A群 RNA载量,但8个样本的Ct值、相对读数和编码序列覆盖率之间没有普遍的相关性。
利用RotaC在线分型工具对8株毒株的全基因组基因型进行测定,结果显示,所有样本的VP1、VP2、VP3、VP6、NSP1、NSP2和NSP5分别具有共同的R1-C1-M1-I5-A8-N1-H1骨架(表1)。对于NSP3,大部分序列为T7基因型,但有2例也存在T1基因型。同样,对于NSP4, E1基因型占主导地位,但在两个样本中发现了E9基因型。这些骨干基因型与比利时参考毒株中观察到的相同(表1)。VP7存在5种不同的基因型:G9基因型最常见(n = 5),其次是G5 (n = 4)、G4 (n = 2)、G3和G11(各1个样本)。除G11外,这些基因型也存在于比利时参考基因组中。G11存在于猪参考分离株YM中。对于VP4,发现了4种不同的基因型:P[13]最常见(n = 5),其次是P[6] (n = 4), P[7]和P[32] (n = 2)。虽然P[13]、P[6]和P[7]也存在于著名的猪参考基因组中,但到目前为止,P[32]只在爱尔兰、英国、丹麦和德国的猪中被报道过。
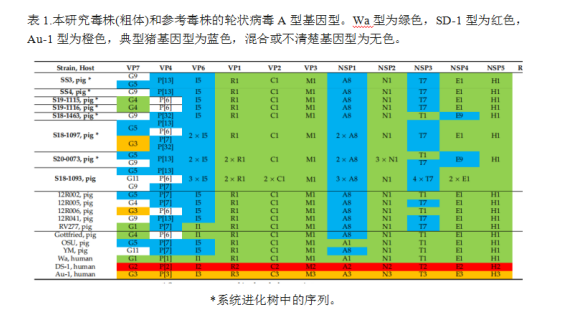
有趣的是,我们发现,在四个病例中,有迹象表明存在多种轮状病毒A群毒株,而其他四个病例似乎是单一毒株的单一感染。就VP4基因而言,在同一样本中发现多达四种不同的基因型,基于VP7基因的基因型则多达三种。在这些病例中,毒株的骨架片段也显示有多个序列,但属于同一个基因型。例如,在S18-1093发现同属基因型T7 (NSP3)的 4个不同序列。
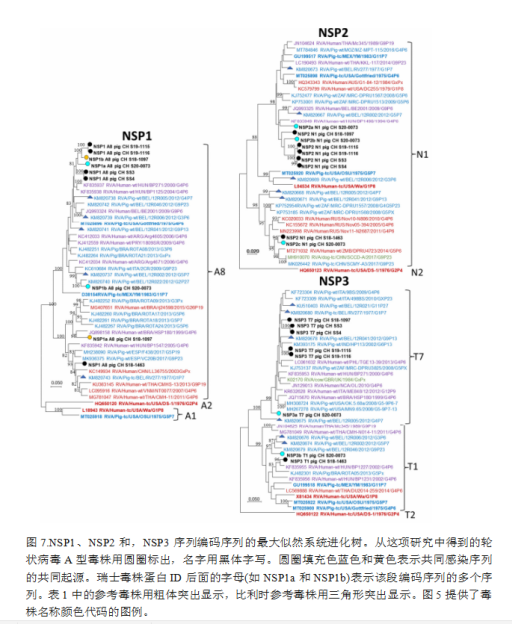
每个编码序列覆盖率在95%以上的7个样品的所有序列用于系统进化树分析。图5-7显示了疑似同时感染的多个轮状病毒A群毒株的多个基因片段(VP7、VP4、VP1、VP6、NSP1、NSP2和NSP3)的系统进化树,而仅有单一感染的毒株的基因片段(VP2和VP3;NSP4和NSP5)显示在补充数据图S3上。就VP7和VP4而言,瑞士猪场分离的这些毒株与猪源毒株的亲缘关系比人源毒株更密切,包括比利时参照序列,或从人上分离但被认为是猪源的毒株。两对样本,S19-1115和S19-1116,以及SS3和SS4来自相同的猪群,显示出相同或接近相同的序列。其余的瑞士序列没有形成与众不同的分支。对于P[32]基因型,只有一个完整测序的参考基因组可用。
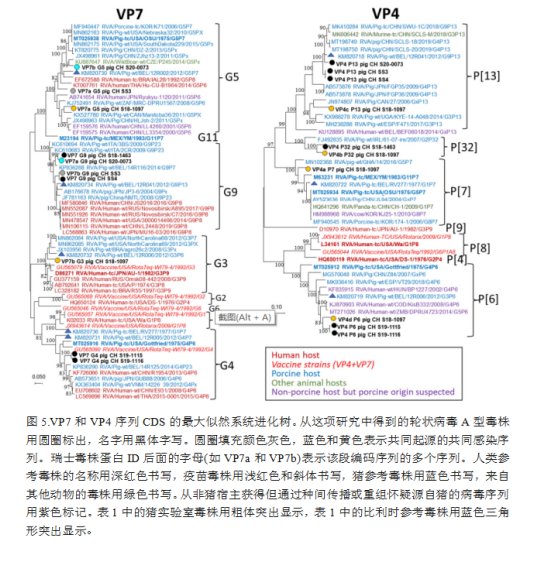
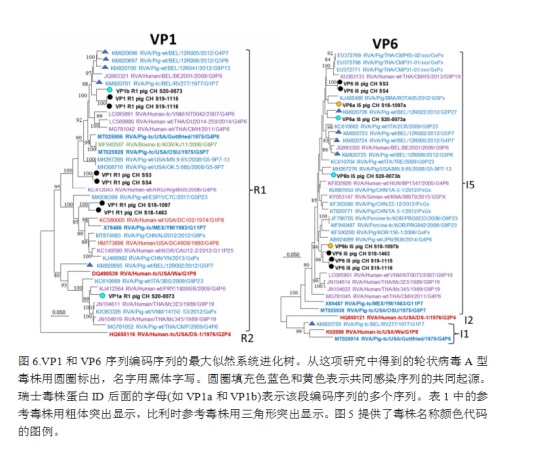
对于VP1和VP6,在分析的瑞士猪中分别发现单一的R1和I5基因型,但在这两种情况下,在同一样本中检测到多个序列(表1、图6)。疑似共感染序列显示出相对较高的遗传距离。所有序列都与猪源的参考文献最密切相关,但没有形成明显的簇类。VP2和VP3分别只检测到C1和M1基因型的单个序列(补充图S3)。与VP1和VP6相比,瑞士毒株密切相关,除了C1中的S18-1097和M1中的S19-1115/-1116这两个“异常值”之外。
在编码非结构蛋白(NSP)的5个片段中,有3个片段被观察到多个同时序列。在NSP1中只发现A8序列,S19-1115/-1116和SS3/-4两个样本对关系密切。它们与S18-1097和S20-0073中的每个序列一起,似乎在A8中形成了一个不同的簇。S18-1463与S18-1097和S20-0073的第二序列亲缘关系较远。在NSP2和NSP3中也观察到类似的情况,除了S18-1463和单个S20-0073序列外,大多数瑞士序列密切相关。相比之下,NSP4和NSP5序列没有簇类。与结构蛋白的编码片段类似,非结构蛋白的编码序列与猪的参考文献的关系一般比与人类的更密切。
4.讨论
4.1横断面研究
在这项研究中95头猪中的89%的粪便样本存在至少一种轮状病毒阳性。这个百分比高于弗拉索夫等人对全球轮状病毒3-63.7%流行率的报告,然而这个数字可能并不代表整个瑞士的猪群,因为病理学研究所提供的样本可能主要来自发病猪。有趣的是,超过三分之二的样本多种轮状病毒种型呈阳性。最常见共同感染类型为轮状病毒A群、B群和C群的三重感染以及轮状病毒A群和C群的双重感染,而轮状病毒B群和C群的双重感染还很少。这一发现与其他的研究的结果相近,其中三重感染占12-21.1%、A群和C群的双重感染占6.7-24%、B群和C群的双重感染占3-8%、A群和B群的双重感染占5-16%。同时以前的研究也发现,单一感染主要发生在轮状病毒A群和C群,而轮状病毒B群的单一感染很少。总的来说,我们发现了断奶猪、三重感染和临床症状(主要指腹泻和消瘦)之间的清晰相关性。作为临床损失的第三个指标,我们评估了绒毛高度-隐窝深度比。然而,尽管绒毛严重缩短猪只的比例随着共感染轮状病毒种类的增加而增加,但是差异不显著,因为在轮状病毒阴性猪只同样出现了中等程度的绒毛缩短。多重感染与腹泻和消瘦的相关性不强的原因是绒毛高度-隐窝深度比的测量相对复杂,理想情况下应在小肠的几个部分同时测量,而我们只有一个单一的部分可测。它还需要完美的肠道状态和对肠内形态的清晰可视化,此外,其他病原体,如猪等孢子虫也可能导致绒毛萎缩从而干扰了本研究的结果。虽然我们可以排除传染性胃肠炎病毒和流行性腹泻病毒,关于其他病原体是否同时存在,各个样本之间存在不一致的情况,因此未能统计分析。我们也不能完全排除其他种类轮状病毒的存在,我们没有在测序数据库中检测到轮状病毒H型,但他们可能会低于检出下限或存在于未测序的样本中。尽管如此,我们的研究结果允许我们做出这样的结论:哺乳仔猪主要是由一种轮状病毒感染,最常见的是轮状病毒A群,但断奶可能激发其他种类的轮状病毒的感染(或排毒),通常与猪只健康度的下降相伴而行。
4.2纵向研究
为了进一步获得轮状病毒种类的动态数据,我们回顾性分析了一组仔猪样本,来自另一项研究中对猪只从断奶到育肥期开始之间的饲养阶段的跟踪。在横断面研究中,大多数样本来自有明显健康问题的猪场,而这个猪场没有严重的健康问题,这在一定程度上阻碍了两个研究相互之间的比较。然而,它仍然为轮状病毒种类的动态和(共同)感染发生的时间轴提供了有价值的信息。与横断面研究相反,在第4周,也就是断奶之前,就观察到较多的仔猪出现轮状病毒A群和C群的双重感染。令人印象深刻的是,仅仅一周后,所有的猪都出现了轮状病毒A群和C群的排毒。在第5周和之后的几周,也观察到三重感染,但不像在横断面研究中那样占主导地位。轮状病毒C群的早期出现与五头母猪中至少有两头出现排毒相关。实时RT-PCR结果显示,在断奶后的第一周,所有猪出现轮状病毒A群和C群的排毒且出现显著峰值。当仔猪被放在断奶栏中时,轮状病毒A群已经呈弱阳性,由于Ct值非常高,尚不清楚该病毒是否具有传染性。以前有研究表明乳源性IgA和IgG可以保护仔猪免受轮状病毒感染。断奶后,仔猪被剥夺了这种保护,因此允许已经存在的轮状病毒感染爆发,并促进轮状病毒新种类的感染。多种轮状病毒的混合感染以前被证明与腹泻有关,似乎会加剧仔猪腹泻的严重程度。我们的横断面研究结果证实了这些发现。然而,尽管轮状病毒A群和C群在第5周大量排毒,并且与横断面研究相反,在纵向研究中只有少数猪出现腹泻症状。由于仔猪腹泻被认为是一种多因子疾病,这可能得益于猪群的总体条件良好,如在这一群体中没有其他病原体。然而,我们没有关于这个猪场的病原体种类的确定性信息。此外,这5头母猪都是高胎次母猪,很可能会给它们的仔猪提供高浓度的抗轮状病毒的母源抗体。Katsuda等人报道,后备母猪(初产母猪)的仔猪有明显更高的轮状病毒流行率,而高抗体滴度降低了早期发生轮状病毒腹泻的风险。腹泻率相对较低的另一个解释可能是,纵向研究中的断奶仔猪大多出现双重感染,而在横断面研究中,我们发现三重感染与腹泻显著相关。然而,要得出最终结论,还需要更多猪场的纵向数据,包括对更多病原体和组织学发现的分析。
4.3轮状病毒毒株的下一代测序和基因分型
我们使用非特异性下一代测序方法,然后采用从头组装方法,从横断面研究中确定轮状病毒A型毒株的全基因组序列。除VP7和VP4外,8个全分型样本的基因型基本相同,均遵循I5-R1-C1-M1-A8-N1-T7-E1-H1模式,该模式在全球猪中普遍存在。在两个样本中,观察到T1和E9的组合而不是T7和E1的组合。虽然T1在全世界的猪中也很常见,但根据NCBI轮状病毒数据库,E9更罕见,只在爱尔兰、加拿大、比利时和西班牙的猪中出现过。VP7和VP4的多样性较高,有5种不同的VP7基因型(G9>G5>G5>G3/G11)和4种不同VP4基因型(P[13]>P[6]>P[7]>P[32])。德国最近的一项研究得出了类似的基因型多样性和频率。然而,我们没有观察到VP4基因型P[23],而这是德国最常见基因型,但我们研究的样本远不能代表瑞士猪轮状病毒的完整多样性。有趣的是在瑞士猪中检测到P[32]基因型,这在德国也很常见,但只在爱尔兰、英国和丹麦报道过,且只有爱尔兰毒株得到了完整的测序。由于样本数量较少,很难断定轮状病毒基因型中是否存在瑞士特异性分支。然而,除了NSP1, NSP2,VP2和VP3基因对应的大多数瑞士毒株序列是密切相关的之外,系统进化树并没有瑞士轮状病毒A群形成的独特性分支。跟之前研究的其他猪病毒,如戊型肝炎病毒(HEV)或非典型猪瘟病毒(APPV)不同,瑞士对活猪进口的严格限制被认为有利于这些病毒形成独立于邻国的个性化进化。由于轮状病毒A群的耐受能力很强,间接传播可能比戊型肝炎病毒或非典型猪瘟病毒更频繁,这为在没有猪移动的情况下病毒的跨国家传播提供了可能。
有趣的是,我们完全测序的样本中有50%显示了几种轮状病毒毒株的存在,这使得想要确定确切的G-P基因型组合是不可能的。虽然我们不能完全排除在尸检分析过程中的交叉污染,但我们使用的测序方法不太可能允许轻微污染产生可分型序列。在非洲和台湾的人类粪便样本中已经发现了多种轮状病毒毒株的感染,并被推定为导致疫苗效率降低的原因之一。Nyaga等人还提供了人源和推定的动物源轮状病毒毒株同时感染并可能导致新的重组毒株出现的证据。Hull等推测,在美国广泛使用的轮状病毒A群活疫苗可能促进轮状病毒A型多样性并引起多重感染。然而,由于瑞士没有轮状病毒A群疫苗,我们可以排除这种解释。据我们所知,到目前为止,只有美国Hull等人和越南Phan在单个病例中检测到猪轮状病毒A群多个毒株的全基因序列。我们的结果表明,多个毒株的同时感染可能比想象的发生得更频繁,可能包括多达四种不同的轮状病毒A群毒株。有趣的是,所有多重轮状病毒A群毒株感染的猪也同时感染了轮状病毒C群和B群毒株,都是5 - 6周大,出现腹泻和消瘦。因此,人们可能会假设,断奶过程可能不仅促进了多个轮状病毒亚群的同时感染,而且也促进了同一亚群的多个毒株的同时感染。组织血型抗原(HBGAs)作为某些轮状病毒群毒株的(共)受体,其表达量变化与年龄相关,从而影响儿童对轮状病毒A群的易感性。组织血型抗原与猪轮状病毒感染的相关性尚不清楚。使用猪G9P[13]基因型毒株的实验指出组织血型抗原和唾液酸对猪和人轮状病毒的作用是相反的。研究年龄和/或断奶诱导的肠道细胞糖基化变化以及不同基因型猪轮状病毒的受体使用情况,有助于更好地了解断奶仔猪对多种轮状病毒感染的敏感性。
5. 结论
显然,为了得出关于轮状病毒感染动态的最终结论,有必要进行进一步的研究,包括能够代表整个瑞士猪种群的样本的采集,纵向研究涵盖更多猪群:不同规模和生产类型的猪群、有或者无轮状病毒健康问题的猪群。
然而,本文提出的横断面和纵向研究为瑞士猪轮状病毒A群、B群和C群的感染和基因多样性提供了一些有价值的初步信息。这两项研究的结果表明,无论是定性还是定量分析,断奶是轮状病毒排毒增加的主要触发因素。此外,断奶似乎也有助于多种轮状病毒种型的感染,导致猪只的腹泻和消瘦。虽然轮状病毒A群基因型的多样性与其他欧洲国家的猪相似,但同时有多达四种轮状病毒A群毒株的共同感染引起了人们对新一代病毒可能导致的人畜共患、毒株重组的担忧。因此,确定影响断奶后轮状病毒易感性的因素不仅可以降低轮状病毒腹泻造成的损失和新的重组毒株产生的风险,还可以在腹泻问题时减少不必要的抗生素治疗。
译者简介

徐晓杰
天康制药技术服务经理
南京农业大学预防兽医学硕士,执业兽医师。先后在江苏温氏、江苏华丽等公司从事猪群健康管理、疾病防控以及猪场规划。