
上一期乳源免疫力系列我们开始谈到轮状病毒,跟大家分享了一个2018发表的以山东省腹泻猪场为对象,调查了不同区域猪轮状病毒的流行情况及其基因分型的研究。该研究发现:山东不同地区出现腹泻的猪场100%检出猪流行性腹泻病毒,60%的猪场检出轮状病毒,10%的猪场检出传染性胃肠炎病毒。随后分别对分离毒株的轮状病毒的VP4、VP6、VP7进行基因测序分析发现山东地区流行的轮状病毒有多个血清型和基因型。其中的轮状病毒的血清型和基因型,大家一定很陌生,此外,如何从疫苗手段来防控轮状病毒一定是大家非常关注的话题。针对以上问题,本期跟大家分享一篇Linda Saif 院士于2017年发表的一篇题为:猪轮状病毒:流行病学、免疫反应和控制策略的综述。
主要观点:
1. 轮状病毒的致病机制:
该病毒通过粪口传播,感染破坏成熟的小肠肠细胞。轮状病毒导致的病变特点是绒毛缩短,有稀疏、不规则的微绒毛,固有层被单核细胞浸润。轮状病毒感染导致腹泻的原因包括肠细胞被破坏而导致的吸收不良、绒毛缺血、感染的上皮细胞神经调节性地释放血管活性物质。另外,轮状病毒非结构性蛋白4(NSP4)作为一种肠毒素和分泌反应的促进因素,通过(i)提高Ca2+依赖性细胞通透性和 (ii)改变上皮屏障的完整性来诱发一系列年龄依赖性和剂量依赖性的腹泻反应(图1)。
2. 轮状病毒的分类:
总体来说,基于血清学或者基因型的病毒分类工作极其复杂,新的成员一直在增多,不断修正原有的分类结果。在电子显微镜观察由3层衣壳蛋白组成的完整轮状病毒(内层、中层和外层衣壳)是一个外缘光滑的近似轮状的粒子。VPl、VP2和VP3蛋白形成内层衣壳, VP6蛋白组成中间层衣壳, VP7和VP4蛋白组成外层衣壳。基于VP6基因核苷酸序列,对同源性大于53%的毒株视为同一基因型,可以将轮状病毒划分为10个轮状病毒群(轮状病毒A-J群)。基于VP7和VP4基因,可以进一步把同群的轮状病毒分为不同的G基因型和P基因型,核苷酸同源性大于80%的毒株定义为同一G(或P)基因型。
2.1对目前为止的轮状病毒A群分离毒株进行分型发现,其G血清型和基因型往往一致,一共27个G基因型。而P血清型和基因型不一定对应,因此,不同轮状病毒P基因型用数字加方括号来区别[(X)],而血清型则不用加方括号,一共37个P基因型。例如:G3P[6]。
2.2鲜有成功分离轮状病毒B群毒株的报道,有关其血清型的信息仍然是未知数。以VP7进行分类,鉴定出21种G基因型。
2.3轮状病毒C群毒株的分离也很困难,也通常不采用血清型对其进行分类。目前,轮状病毒C群毒株分为13个G基因型和8个P基因型。
3.轮状病毒的免疫策略:
人的轮状病毒A群毒株可以感染仔猪,并诱导出临床症状。因此,很多人类轮状病毒感染/疫苗的研究使用悉生猪模型(SPF母猪剖腹产仔猪无菌饲养)(图4)。但是,关于猪轮状病毒的致病机理、免疫机制和疫苗开发的报道甚少,我们只能通过猪感染人轮状病毒后的免疫反应和猪上人轮状病毒疫苗的评估研究来思考猪用轮状病毒疫苗的研发方向和策略。可以预料,同对PEDV的保护完全依赖乳源免疫力一样,猪轮状病毒的免疫策略,也应该是思考如何提高母猪的乳源免疫力,通过初乳和常乳向新生仔猪提供有效的被动保护。
Porcine Rotaviruses: Epidemiology, Immune Responses and Control Strategies
猪轮状病毒:流行病学、免疫反应和控制策略
原文链接:
https://xueshu.baidu.com/usercenter/paper/show?paperid=db44e088dfa7633c091789ce5de23b59
摘要
轮状病毒是导致全世界幼龄动物和儿童急性病毒性胃肠炎的一个主要病原。由于感染后免疫力的建立、免疫系统的进一步成熟和肠道的生理变化,不同物种的免疫反应正常的成年动物都能对临床发病产生抵抗力。在9个基因群的轮状病毒(A-I)中, A、B和C群轮状病毒与仔猪的腹泻有关。尽管几十年前就发现了E群猪轮状病毒,但并不常见,对其发病机制也没有透彻的研究。最近在日本、巴西和美国的腹泻猪中,证实了H群猪轮状病毒的存在,这是一个新定义的独特的基因群。猪轮状病毒复杂的流行病学、致病性和遗传多样性得到了广泛认可和深入研究。最近对B群和C群猪轮状病毒毒株的VP7基因分析揭示其具有显著的遗传多样性。本综述中,我们将总结过去和近期的研究,就猪轮状病毒在不同地域和生产体系中的过去的和当前的流行率与遗传多样性进行探讨。我们将简单介绍猪轮状病毒的免疫反应、可用的控制策略和不同基因群轮状病毒的人畜共患的潜力。对上述参数的进一步了解将有助于制定更好的策略来控制猪和人中轮状病毒导致的腹泻疾病。
1、简介
轮状病毒被公认为是幼龄猪只(包括哺乳期和断奶期的仔猪)急性胃肠炎的一个主要原因。轮状病毒的名称来自于在电子显微镜下观察到的病毒粒子有着轮状的外观。该病毒通过粪口传播,感染破坏成熟的小肠肠细胞。轮状病毒导致的病变特点是绒毛缩短,有稀疏、不规则的微绒毛,固有层被单核细胞浸润。轮状病毒感染导致腹泻的原因包括肠细胞被破坏而导致的吸收不良、绒毛缺血、感染的上皮细胞神经调节性地释放血管活性物质。另外,轮状病毒非结构性蛋白4(NSP4)作为一种肠毒素和分泌反应的促进因素,通过(i)提高Ca2+依赖性细胞通透性和 (ii)改变上皮屏障的完整性来诱发一系列年龄依赖性和剂量依赖性的腹泻反应(图1)。

图1.轮状病毒的潜在致病机制
轮状病毒在肠细胞内的复制会诱发渗透性腹泻,轮状病毒增加了细胞内(Ca2+)的浓度,破坏了细胞骨架和细胞间的紧密连接,增加了细胞间的通透性。此外,轮状病毒产生非结构性蛋白4(NSP4)-一种肠毒素,通过磷脂酶依赖性(PLC)机制诱导Ca2+从内质网流出,进一步导致电解质失衡和分泌性腹泻。轮状病毒还可以刺激肠道神经系统(ENS,通过NSP4依赖机制),进一步促进分泌性腹泻和增加肠道运动。抑制肠神经系统的药物可能缓解儿童的轮状病毒腹泻。在酶催化降解VP5蛋白产生了VP8蛋白后,VP8蛋白改变了(claudin-1、occludin和ZO-1)紧密连接的蛋白的定位,导致紧密连接屏障完整性的破坏。在感染过程的后期,轮状病毒会破坏成熟的肠细胞,进一步导致吸收不良或渗透性腹泻。轮状病毒的抗原、基因群RNA和感染性颗粒已经在幼年动物的血液和全身器官发现。轮状病毒的全身性分布在疾病发病机制中的作用目前还不清楚。
轮状病毒是呼肠孤病毒科中的一个属,是双链RNA(dsRNA)病毒,其基因群由11段dsRNA群成,编码6种结构性蛋白(VP1-VP4、VP6和VP7)和5种非结构性蛋白(NSP1-NSP5/6)。根据其VP6蛋白的抗原关系,轮状病毒s被分为10群(A-J)。最近在匈牙利的流浪犬和塞尔维亚的蝙蝠中分别发现了临时命名的I和J群。外面的核衣壳蛋白VP7和VP4能诱导中和抗体,是构成G和P双基因分类系统的基础。感染人类和动物的最常见的是A、B和C群(轮状病毒A群、轮状病毒B群和轮状病毒C群),其中轮状病毒A群的流行率最高,从人类公共卫生和动物健康的角度看,它是急性脱水性腹泻的最主要原因之一。到目前为止,在人类和动物中已经报道了轮状病毒A群的27种不同G群和37种P群基因型。对于高度遗传多样性的轮状病毒A群毒株,双基因(G/P)分群系统在2008年被扩展到全基因组分类系统,对所有11个基因片段确定了核苷酸相似度的临界值,用Gx-P[x]-Ix-Rx-Cx-Mx-Ax-Nx-Tx-Ex-Hx来分别表示VP7-VP4-VP6-VP1-VP2-VP3- NSP1-NSP2-NSP3-NSP4-NSP5/6个编码基因。
随后,轮状病毒分类工作群(RCWG)成立,制定轮状病毒A群分类指南并维护现有的分类结果,以促进新群轮状病毒毒株的完整分类。目前,只有轮状病毒A群的分类已经完成,并由轮状病毒分类工作群维护。而对非轮状病毒A群病毒感染的流行病学和疾病损失的了解则少得多。而对与非轮状病毒As感染相关的流行病学和疾病损失了解甚少。然而,轮状病毒B群、C群、E群、H群和I群已在各种哺乳动物的零星、地方性或流行性感染中检测到,而轮状病毒D群、F群和G群则在家禽发现,如鸡和火鸡。A、B、C、E和H群轮状病毒已经在猪上报道。
1969年,牛轮状病毒是第一个通过细胞培养分离得到A群轮状病毒,并确认为导致小牛腹泻的原因。之后不久,Bishop和他的同事于1973年发现了人轮状病毒。随后的研究记录了轮状病毒A群感染在幼年动物(包括小牛和猪)中的广泛流行情况,以及它们与小于1个月的幼龄动物的腹泻有关。C群轮状病毒于1980年首次在仔猪中分离出来,随后在其他动物和人类中被发现。猪轮状病毒B群首次于上世纪80年代在一头腹泻的猪身上发现,被当做一种类似轮状病毒的病原体。除猪外,牛上、羔羊和大鼠上也发现了轮状病毒B群。与世界范围内描述的人轮状病毒A和轮状病毒C相比,人轮状病毒B毒株只在中国、印度和孟加拉国被报道过。一个非典群的E群猪轮状病毒只在英国的猪群中被报道过,一项血清学调查表明,猪轮状病毒在英国是广泛存在的,在10周以上的猪群中广泛分布着这种病毒的抗体。最近,日本、巴西和美国的猪都出现了轮状病毒H毒株。据报道,至少从2002年开始,这些病毒就在美国报道。
2、猪的轮状病毒基因群
基因群分类和流行情况
世界各地的猪都被证实受到过轮状病毒A群的感染,无论是否导致了腹泻。猪的轮状病毒A群流行率从3.3%到67.3%不等,没有季节性特点,但有时空差异性和某些基因群的重新出现,包括G9和G1,农场的流行率达到61%-74%。12种G基因群(G1至G6、G8至G12和G26)和16种P基因群(P[1]至P[8]、P[11]、P[13]、P[19]、P[23]、P[26]、P[27]、P[32]和P[34])的轮状病毒A群与猪相关。然而,G3、G4、G5、G9和G11历来被认为是猪体内最常见的G基因群,通常与P[5]、P[6]、P[7]、P[13]和P[28]有关。
与轮状病毒A 群类似,猪轮状病毒C群在世界大部分地区都有报道。腹泻的暴发与轮状病毒C群有关在哺乳期、断奶期和断奶后的仔猪身上都有报道,包括轮状病毒的单独感染和与其他肠道病原体的混合感染。此外,猪的轮状病毒C抗体阳性率高达58%-100%,表明轮状病毒C的感染可能非常普遍,并且在发达国家的猪群中已经流传了几十年。最近美国和加拿大学者对猪的研究表明,轮状病毒C群的流行率为46%,在新生仔猪(78%,≤3日龄)和哺乳仔猪(65%,4-20日龄)群体中更高。猪轮状病毒C群的早期分离毒株Cowden和HF毒株分别被命名为G1和G3基因型。将轮状病毒C群毒株通过基于序列的基因分型,共鉴定了9个G基因型(G1-G9)、7个P基因型(P1-P7)和7个I基因型(I1-I7)。另外也有基于11个基因片段测序结果对轮状病毒C群进行分型的研究;但是,目前只有有限的基因序列可用。猪轮状病毒C群属于G1、G3、G5-G9基因型和一个新的G10基因型,而牛和人的轮状病毒C群分别被分为G2和G4基因型。此外,两个临时G基因型(G12和G13,基于86%的核苷酸同源性临界值)由Niira等人根据他们最近的结果提出。
由于轮状病毒B群毒株难以进行细胞培养,所以其分子特征的快速研究进展缓慢。此外,轮状病毒B群病毒的粪便排毒有限,波动大,且不稳定。来自东南亚的几个人轮状病毒B群毒株获得了完整的基因群序列,对几个大鼠和牛的轮状病毒B群毒株进行了部分基因的测序。Kuga及其同事分析了38株猪轮状病毒B群毒株的VP7基因序列,提出了5种基因型,使用67%和76%的核苷酸同源性临界值(氨基酸同源性分别为66%和79%),进一步将其分为12个亚群。Marthaler等人最近的研究基于68个轮状病毒B群毒株(2009年从美国14个州和日本收集)的VP7基因的测序结果,选择80%的核苷酸同源性为临界值,确定了20个G基因型,揭示了更加广泛的基因多样性,据此第一次提出了猪轮状病毒B群可能具有宿主物种特异性和区域特异性。因此, G1、G2和G3/G5基因型的猪轮状病毒B群毒株只在大鼠、人和牛中发现,而G4、G7、G9、G13、G15和G19基因型的猪轮状病毒B群毒株只在日本的猪上发现,而少量G10和G17基因型的猪轮状病毒B群毒株只在美国发现。此外,在印度的猪身上发现了另外一种G基因型G21。
在1997-2002年报道三株来自亚洲的人轮状病毒H群毒株(AD轮状病毒-N,J19,B219)和一株猪轮状病毒H群毒株(SKA-1)。2012年,又有三个来自巴西的猪轮状病毒H群毒株BR63、BR60和BR59被鉴定出来。最近,Marthaler及其同事证明了猪轮状病毒H群的高流行率(15%),主要是在21-55日龄的猪中。他们的数据表明,猪轮状病毒H群毒株至少从2006年开始在美国猪群中传播,并且它们在进化上与人的轮状病毒H群毒株不同,也与巴西和日本的猪轮状病毒H群毒株不同。对南非猪轮状病毒H群毒株的全基因序列分析表明,新的轮状病毒H群毒株MRC-DPRU1575与SKA-1毒株和来自巴西的已知猪轮状病毒H群毒株和来自巴西和美国的已知猪轮状病毒H群毒株(仅针对可用的基因群片段)在同一个分支上。然而它与来自亚洲的人轮状病毒H群毒株和最近在喀麦隆的蝙蝠中检测到的轮状病毒H群毒株的关系较远。
因为猪轮状病毒E群大约30年前才在英国被发现,此后再没有关于其分离区域扩大或宿主范围扩大的报道,需要更多的数据来评估猪轮状病毒E群毒株的流行病学意义。
3、猪轮状病毒在美洲大陆的分布基因型流行率和时空变化
(略去不译)
4、猪轮状病毒在全球的分布
基因型流行率:非洲、欧洲、亚洲和澳大利亚
(非洲、欧洲、澳大利亚部分,略去不译)
4.3.亚洲
在亚洲国家进行的许多流行性调查表明,不常见的轮状病毒A群怀疑来自动物或者人源和动物源病毒的重组,包括在全球或者区域范围内出现的猪和人的G9基因型,需要仔细监测动物的轮状病毒。Teodoroff等人(2005)报道,G9基因型在2000年至2002年期间日本幼猪腹泻爆发有关的猪轮状病毒A群中占主导地位。同样,Miyazaki等人(2011年)证明,G9P[23]、G9P[13]/[22]、G3P[7]和P[7]与一个无法归类的G基因群相结合,导致了2009-2010年日本四次不同的腹泻,几乎影响了20%-30%分泌母猪所生的所有乳猪。此外,这项研究还提供了证据,证明不可归类的G基因群是一种新的猪轮状病毒A群G26基因型,并得到了轮状病毒分类工作委员会的确认。2012年对越南湄公河三角洲的小养猪场进行了一次大规模的监测,结果表明猪只层面和猪场层面的猪轮状病毒A群的总体流行率为32.7%(239/730)和74%(77/104);但是,没有观察到与此相关的临床疾病。该研究还确定了六种不同的G群和四种P群的不同组合形式(G2、G3、G4、G5、G9、G11和P[6]、P[13]、P[23]和P[34])。此外,还发现了一个G26基因型毒株。在泰国,2000-2001年收集的样本中发现了一种新的基因型P[27]和G2的组合。Saikruang等人(2013年)报道,在泰国的仔猪腹泻样品中(2009-2010年),猪轮状病毒A群的总流行率为19.8%(207个样品),具有更多的G-P组合的种类[78]。在这项研究中,G4P[6]被确定为最普遍的基因型(39.0%),其次是G4P[23](12.2%),G3P[23](7.3%),G4P[19](7.3%),G3P[6](4.9%),G3P[13](4.9%),G9P[13](4.9%),G9P[19](4.9%),G5P[6]和G5P[13]各为2.4%。此外,G5和G9与P群不可分类毒株的组合也占了2.4%(n=1)。在不同的猪轮状病毒A群毒株中,首次发现G4P[19]和G9P[19]基因型组合,这进一步证实了猪轮状病毒A的非经典G和P基因型的出现和广泛流行。在泰国北部(2006-2008年),从患腹泻的仔猪采集的猪轮状病毒A样本中,92.9%属于罕见的P[23]基因群G9P[23]的组合。G9P[23]组合也在中国的猪群中传播。G9基因型与P[7]和P[23]基因型组合的猪轮状病毒A群毒株被分离出来,被确定为韩国腹泻猪中仅次于G[7]和P[23]基因型的第三大基因型。Malik及其同事的一篇综述总结了各种监测结果(使用ELISA、PAGE和基于PCR的分群),表明G4、G6、G9、G12和P[6]、P[7]、P[13]和P[19]基因群在印度不同地区的存在。虽然在中国没有大规模监测记录,但腹泻仔猪的轮状病毒A群G9P[7]基因型在中国江苏省被证实,这表明各种G9基因型在大多数(如果不是全部)亚洲国家都有传播。
尽管关于亚洲国家猪轮状病毒C群流行情况的信息有些匮乏,有几份报告报道了在日本和韩国发现的不同基因型的猪轮状病毒C群。在日本报道的基因型包括G1, G5, G6, G9, G12和G13等G基因型与P1、P4-P6等P基因型组合在一起,而G3、G5、G6和G7等G基因型则被证实在韩国传播。关于猪轮状病毒C群在中国也有报道,在腹泻和无症状的仔猪中的流行率为16.65%(2007-2008);但是没有基因分型的数据。
与猪轮状病毒C群的数据类似,关于猪轮状病毒B群的流行率和在大多数亚洲国家流行的优势基因型的信息非常有限。在日本的一些研究中,猪轮状病毒B群特异性抗体在猪粪便和血清样品中的流行率很高。此外,在2000年至2007年期间,在日本收集的猪样本中发现了G3-G6、G8、G9、G11、G12-G15和G18-G20基因型,并在基因型中发现了不同的亚型。印度的一份报告强调了猪轮状病毒B群显著的基因多样性,表明至少有G7、G19、G20和暂定的新的G21基因型(与H4和H5基因型相关)在印度北部和西部地区流行。
5、猪轮状病毒的人畜共患能力
(略去不译)
6、被动免疫和主动免疫
人和多种动物对轮状病毒(主要是对轮状病毒A的保护)的免疫反应和保护力相关指标已有专门的综述。大部分关于轮状病毒免疫反应的知识来自于悉生猪模型和对人类轮状病毒感染/疫苗的研究。在本综述中,我们将简要总结由人轮状病毒A群毒株诱导的猪的被动和主动免疫反应,因为猪和人的轮状病毒A群毒株可以感染仔猪(图4),并表现出临床症状。在先天性免疫方面,我们最近的研究表明人轮状病毒感染猪后的临床症状和感染的严重程度的降低与全身性和局部性的浆样树突细胞(pDC)和自然杀伤(NK)细胞的功能和数量的增强以及全身性IL-12反应有关,这些结果与人类和小鼠上的结果相似。虽然干扰素(IFN)-α在防止同源/异源轮状病毒感染中的作用尚无定论,但早些时候我们证明,IFN-α的产生不平衡与人类轮状病毒疾病/感染的增加相吻合。此外,TOLL受体3(识别双链RNA)的表达增加与悉生猪感染人轮状病毒后的保护力提高有关,这表明它可能是一个有吸引力的治疗靶标。最后,在我们最近的研究中,悉生猪仔猪上人轮状病毒感染后的复制的减少与系统性或者局部性抗体反应的增加有关。
来自猪上研究表明:口服人轮状病毒疫苗诱导的对人轮状病毒(G1P[8])攻毒的保护的相关性指标是指血清或肠道中存在的轮状病毒特异性IgA抗体水平或抗体分泌细胞(ASC)以及产生IFN-γ的CD4+T细胞的频率,而不是指肠道或全身的中和抗体或VP6特异性IgA抗体的水平(图4)。口服减毒的人轮状病毒疫苗可以为仔猪提供保护,这个保护力可以用VP 2/6病毒样颗粒(VLPs)来加强。这种保护与针对VP4和VP7的免疫反应有关 。然而,对人轮状病毒 NSP4的全身性和肠道免疫反应与悉生猪对人轮状病毒感染的保护力并不相关。虽然母源抗体对人轮状病毒疾病有高水平的被动保护作用,但对复制性的和非复制性的人轮状病毒疫苗的主动免疫反应是抑制的。这一点从肠道中ASC数量的减少可以看出,这降低了实验攻毒时的保护。
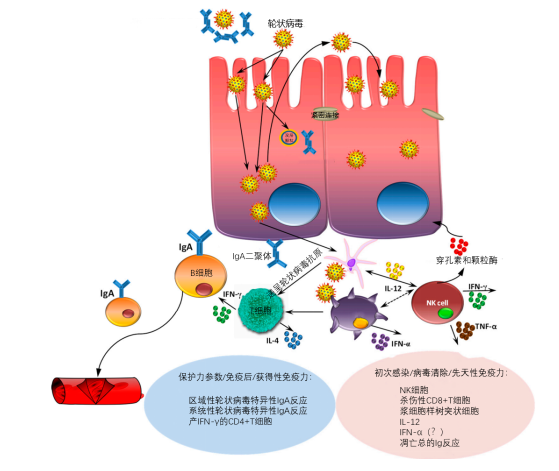
图4. 猪对轮状病毒感染的免疫反应
肠道中针对轮状病毒VP4和VP7的分泌性免疫球蛋白A(sIgA)是中和抗体,可以阻止病毒与肠细胞的结合和进入(感染后早期),而病毒的复制可以被跨过肠细胞转运的VP6特异性sIgA抑制。此外,一些免疫细胞对轮状病毒的先天和适应性免疫反应也有贡献:浆细胞树突状细胞产生IFN-α和IL-12可以抑制轮状病毒的复制或诱导其他免疫细胞包括NK细胞,产生颗粒酶、穿孔蛋白和TNF-α,裂解被轮状病毒感染的细胞。传统树突状细胞向T细胞呈递抗原后,细胞因子分泌的轮状病毒特异性Th细胞也能抑制病毒复制并激活B细胞产生IgA。此外,轮状病毒特异性CD8+T细胞分泌IFN-γ,有助于裂解轮状病毒感染的细胞。轮状病毒诱导肠细胞和免疫细胞的凋亡;然而,目前还不清楚这是为了消除已感染的细胞(减少病毒复制)还是促进感染性病毒颗粒的传播(增强病毒的复制)。虽然高水平的轮状病毒中和抗体可能与轮状病毒疫苗的保护相共存,但在大多数研究中,它们与保护效果并不相关。
7、猪轮状病毒A群疫苗和控制策略:疫苗对猪轮状病毒A群基因多样性的潜在影响
尽管在全世界范围内应用人轮状病毒疫苗后,腹泻导致的儿童死亡率有所下降,但轮状病毒仍然是5岁以下儿童严重脱水性腹泻的最常见原因。在动物方面,疫苗接种策略主要是诱导主动或被动免疫,然而,对仔猪和犊牛口服减毒的轮状病毒疫苗往往没有保护力 。猪轮状病毒呈地方性流行,猪轮状病毒抗体阳性猪的普遍存在,揭示了需要制定提高母猪母源免疫力的免疫策略,通过初乳和常乳向新生仔猪提供被动保护。受疫苗剂量、毒种、灭活剂、佐剂、免疫途径和猪轮状病毒感染水平的影响,母猪上使用轮状病毒疫苗的免疫效果差异很大。使用基因工程改造的VLP疫苗来提高乳中的抗体是有希望的,因为它们是不需要复制的,可以规避母源抗体的干扰。然而,尽管这种VLP疫苗的免疫原性很高,但诱导的保护效力不足,需要用减活的轮状病毒疫苗作为首免。然而,猪场使用的猪轮状病毒A群疫苗包括ProSystem公司的包含G4P[6]和G5P[7]基因型组合的弱毒疫苗或OSU生产的G5P[7]基因型弱毒疫苗,可能导致猪轮状病毒疫苗毒广泛传播了几十年,这些疫苗最近被G9和G11基因型或重组体G4和G5变异毒株取代。另一方面,也许它们可以产生群体免疫力,逐渐减少猪轮状病毒A群 G4/G5基因型毒株的流行,但会促进新的猪轮状病毒A群毒株的出现。
8、结语
猪轮状病毒非常多的血清型和不断变异的基因表明需要进一步研究地方流行和新出现的猪轮状病毒的分子特征、时空流行率和波动规律,最近在世界范围内出现了不常见的G和P基因型的猪轮状病毒A群毒株,在不同区域发现的猪轮状病毒新亚群,以及越来越多的证据表明轮状病毒的流行率在增加,有着远超预期的基因型种类,这些都说明猪轮状病毒的流行病学是非常复杂和高度动态的。
这些观察结果至少可以有两个推论:(i) 分子诊断和基因特征分析的工具箱应及时更新来涵盖新的猪轮状病毒变异毒株,以确保准确的流行病学监测(特别是缺乏此类信息的国家-非洲、俄罗斯、澳大利亚等);(ii)需要更好地了解猪轮状病毒的分子发病机制和免疫力,以优化和完善经典的疫苗策略,来控制猪轮状病毒的感染和传播。猪场使用轮状病毒疫苗并不十分有效,而猪轮状病毒A群减毒活疫苗可能直接导致了猪轮状病毒的不断变异(通过疫苗毒和野毒的重组以及进一步传播),并不断催生新的变异毒株,逃避现有疫苗的群体免疫,正如在人轮状病毒A群疫苗使用中观察到的那样,疫苗毒株、疫苗毒和野毒重组毒株能够在易感人群中的进一步传播。疫苗之外的其他办法,包括益生菌使用或其他治疗手段,干扰病毒复制周期,来增强先天或后天的免疫反应,减少轮状病毒排毒和环境污染,并减轻猪轮状病毒介导的肠道损伤。最后,尽管之前没有很好地研究轮状病毒,但应通过对同一区域的人和猪的轮状病毒同时进行流行病学研究,对各种猪轮状病毒基因群的人畜共患潜力进行仔细和广泛的评估。需要进行更多的研究,以了解某些基因群产生重组毒株和跨物种传播的可能性,包括不同猪轮状病毒基因群与组织血型抗原的潜在相互作用,人轮状病毒毒株也有类似报道。
10、译者简介

李程
天康生物技术服务经理
硕士毕业于华中农业大学预防兽医专业,从事疫苗研发工作。曾在集团负责生产管理类工作,熟悉现代化猪场的生产管理,生物安全体系建设等。