
自2011年以来,中国猪场的伪狂犬防控多了一个伪狂犬变异毒株(后推定为基因2型)的新敌人,不少人也把伪狂犬防控的大好形式毁于一旦的罪魁祸首归咎于变异毒株的出现。基于2008年到2020年我国猪场伪狂犬阳性率的变化来看,伪狂犬防控经历从治到大乱到再治的过程,尤其是最近5年来,伪狂犬净化场数量日趋增多,大家已经逐步开始把伪狂犬的防控当做一件非常容易的事情来看待。更有甚者,在降本增效的驱使下,商品猪又开始了仅仅免疫一次的尝试,如同2008-2011年不少企业的做法一样。
痛定思痛,痛何如哉。
难道伪狂犬发再流行的根本原因就是伪狂犬病毒变异了吗?反观这些年,千呼万唤的伪狂犬变异毒株疫苗,迟迟未能上市,大家手中的疫苗还是原来的疫苗毒株,统称为经典毒株(基因1型),也实现了伪狂犬是有效防控,乃至净化。其中的措施包括但不仅仅限于,加强生物安全,增加免疫频率,优化免疫程序等。
在免疫程序这方面,滴鼻免疫作为一个新的免疫方式,其有效性一直未被客观评估和科学探究过。尽管生产中,一些BARTHA-K61疫苗的厂家推荐阳性场,滴鼻+肌注,相对于两次肌注免疫,可以更快实现转阴,但其中的有效性也一直被诟病和存疑。许多公司, 因为滴鼻的繁琐和对其效果的不信任,除非产房有神经症状的仔猪,一般还是用肌注或者超前免疫(肌注)来代替滴鼻。
本译文对应的研究的国家是希腊,其养猪业也饱受伪狂犬的折磨,阳性场达30%之多,最近也分离到了伪狂犬新流行毒株,但属于基因1型,他们使用的疫苗是Bartha-K61疫苗。于是,作者在生物安全等级3级的高度密闭和独立的环境下,开展了一项对世界养猪业都有重要意义的研究,也回答了我们一直关注的滴鼻+肌注免疫组合下,Bartha-K61疫苗对伪狂犬变异毒株(中国新分离株HeN1)攻毒的保育猪是否提供完全保护的问题。
具体内容,请读译文,并参考原文(若有翻译错误,请联系我们)。
Bartha-K61疫苗对用伪狂犬经典毒株(欧洲新分离株)和变异毒株(亚洲新分离株)攻毒的保育猪都提供完全保护
Bartha-K61 vaccine protects nursery pigs against challenge with novel european and asian strains of suid herpesvirus 1
全文链接:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9215027/
摘要
本次研究是为了解2种最近分离的猪伪狂犬毒株,即希腊Hercules毒株和中国HeN1毒株,对未免疫疫苗的猪和免疫Bartha-K61疫苗株的猪的致病性。实验在负压房(隔离器)中进行,选取45日龄伪狂犬血清抗体阴性的猪只,实验组口鼻/肌注免疫Bartha-K61疫苗,对照组未免疫疫苗,然后用猪伪狂犬病毒Hercules毒株或HeN1毒株进行攻毒。攻毒后的20天内,每天观察所有动物的临床体征和体温,并采集鼻拭子、粪便、血液样品和体重数据。
结果表明
1.在未接种疫苗的两组猪只中,HeN1毒株的毒力高于Hercule毒株,表现为死亡率增加,死亡时间缩短,临床症状更明显(p<0.05)。但是,在接种Bartha-K61疫苗的两组猪只中,发病率、死亡率、体重减轻和病毒排出量均有大幅下降,而且降幅几乎相同(p<0.05)。
2.除了HeN1攻毒猪只在攻毒后2天和第3天的体温和临床评分有轻微升高外,两组免疫攻毒组的猪只与未免疫未攻毒的对照猪只之间在体温和临床评分方面没有显著差异,而体重增加与未免疫未攻毒的对照猪只相似。
3.我们的研究表明,虽然毒力不同,但Bartha-K61疫苗的标准免疫方案可以保护保育猪免受欧洲新分离毒株(基因1型)和中国变异毒株(基因2型)的感染。
关键词
伪狂犬病,奥耶斯基氏病,Bartha-K61疫苗,猪,变异
简介
奥耶斯基氏病(AD)或伪狂犬病,由猪疱疹病毒1型(SuHV1)引起的一种急性的、通常致命的疾病,主要感染猪,偶然感染其他动物家畜和野生动物。自20世纪60年代以来,随着养猪产量的增长,猪伪狂犬病毒已经成为一种重要的全球性的病原体。今天,虽然在一些国家已经根除了这种疾病 ,但在世界许多地区该病仍在流行。这种病的表现取决于受感染猪的年龄,感染毒株的毒力,以及之前是否有过接触和自身免疫状态。在无免疫力的猪中, 新生儿通常死于典型的神经系统疾病体征(如颤抖、后肢无力和失去协调性),而断奶猪(3-9周龄)则表现出临床症状与乳猪相似,但没那么严重。在育成猪和育肥猪中,猪伪狂犬病毒感染通常是轻微的,其主要特征是呼吸道症状,而在母猪中则可以看到生殖障碍。尽管知道该病毒只有1个血清型,但有些毒株似乎在抗体阴性猪的表现出毒力增强。
缺失gE糖蛋白的弱毒疫苗或灭活疫苗被成功用于控制伪狂犬病。大多数弱毒疫苗使用Bartha-K61毒株和许多欧洲国家已通过使用含有这种毒株的疫苗消除了该疾病。在没有强制性根除计划的国家,选择性免疫的确减少了伪狂犬感染后的临床症状,但是无法清除病毒。在希腊,虽然伪狂犬疫苗免疫得到普遍执行,但是约30%的猪场仍为猪伪狂犬病毒阳性。关于这些阳性场观察到的伪狂犬疫苗保护力不足是由于疫苗本身,还是由于免疫不到位造成的,从未有过相关的调查。
自2011年底以来,在使用Bartha-K61疫苗的中国猪场中出现了新的伪狂犬毒株。这些最新出现的毒株被归类为新的基因II型,以区别被划分为基因I型的已知毒株。在为数不多的实验室研究中,与中国其他新型候选疫苗(基于变异毒株开发的,译者注)相比,Bartha-K61疫苗对中国基因型II型田间毒株表现出减弱或类似的效力。
本研究的目的是比较研究最近分离的2株野毒株(一株来自欧洲基因型I型,另一株来自中国基因型II型)对抗体阴性猪的致病性,并测试众所周知的Bartha-K61弱毒疫苗株对这两株毒株的保护效力。
材料和方法
病毒和商业疫苗
两株有毒力的猪伪狂犬野毒株均分离自有神经症状猪的脑组织匀浆:a)2010年在一个新生猪和宠物猪出现神经症状的希腊猪场分离出了欧洲希腊毒株(Hercules),b)2012年在以前接种过Bartha疫苗的猪场分离出了中国株(HeN1)。两株菌株均在PK-15细胞上经过2至3次传代,经反复冻融收获病毒,然后4°C1000 g离心10分钟来提纯病毒。病毒液用泛病毒芯片测试了外源性病原,结果既无支原体又无其他已知的病毒。
Hercules株经过全基因测序分类,根据最近的猪疱疹病毒1基因分型标准,跟所有已知的非中国分离毒株一样属于基因型I 。相比之下,HeN1属于推定的基因型II,包括其他最近分离的中国毒株。根据遗传距离计算,这两株SuHV1已被分别被指定为SuHV-1.2(主要欧洲/美国)和 SuHV-1.1(中国)。
本研究中使用的疫苗为Ingelvac®公司的伪狂犬活疫苗(批号1951138A勃林格殷格翰,德国),这是一种基于伪狂犬病毒基因1型的Bartha-K61毒株的弱毒疫苗。
动物和饲养
试验猪来自在一个300母猪,从分娩到育肥一条龙商品猪场,试验前已进行了血清学检测,确定没有感染PRRSV,PCV2和猪伪狂犬病毒,且没有针对这些疾病进行疫苗免疫。
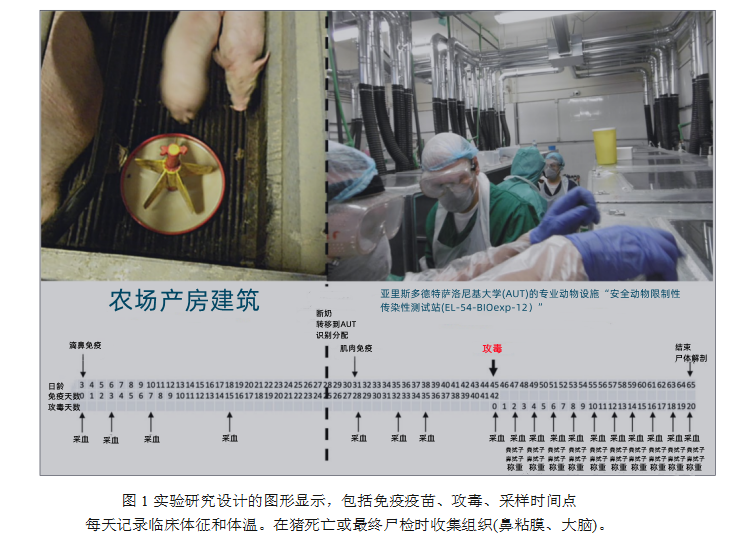
这项研究是在来源猪场的一个隔离室中开始的,小猪在那里接受了第一剂疫苗。随后,将仔猪移到亚里斯多德特萨洛尼基大学(AUT)的专业动物设施,安全动物限制性传染性测试房(EL-54-BIOexp-12)”(许可号290287/2442-29.09.2014),满足动物生物安全三级要求,在那里进行第二次疫苗免疫和攻毒研究。每个测试房的尺寸为80cm×80cm ×140cm(图1)。
28日龄断奶的仔猪被转移至亚里士多德大学进行再次疫苗接种和攻毒(图1)。到达后,所有仔猪都通过在颈部皮下植入热微芯片进行识别,根据是否同窝幼崽和性别在组间和组内进行随机分配。在试验期间,所有仔猪都可以自由采食提前称量过的饲料,且自由饮水。由于每头仔猪都是单独饲养,并且完全独立于其他猪,所以每头猪都代表一个独立的实验单元(重复)。
疫苗接种和攻毒程序
在来源猪场,两个妊娠母猪搬至一个独立房间。分娩3天后,挑选同窝内仔猪,按照使用说明用2 mL疫苗进行鼻内接种(1 mL或104.9 TCID50 /鼻孔)后放回母猪处(图1)。
28日龄断奶时,10头免疫疫苗的仔猪和14头未免疫疫苗的仔猪从来源猪场搬到了亚里士多德大学并安置在单独的测试房中以适应(图1)。
31日龄(第一次免疫疫苗后4周)时,滴鼻接种一次疫苗的猪按照使用说明肌注第二针2 mL疫苗(图1)。
42至45日龄进行攻毒(无论是否接种疫苗),攻毒毒株(Hercules或HeN1)经口鼻攻毒,总体积为4 mL,1ml病毒含量107.5 TCID50(即108.1 TCID50/猪)。攻毒过程中,猪镇静后仰躺,使用4 cm长导管在2个鼻孔各接种1 mL、口腔中接种2ml悬浮液。猪保持此姿势5分钟。对剩下的病毒液进行校对滴定(如“病毒定量”部分所示),以确保正确的病毒滴度。
实验设计
选取24头45日龄生猪分为5组: G1组为对照组,该组猪未免疫疫苗且未进行攻毒(n = 4);G2组的猪未免疫疫苗,用Hercules毒株通过口鼻进行攻毒(n = 5);G3组的猪未免疫疫苗,用HeN1毒株通过口鼻进行攻毒(n = 5);G4组的猪免疫过疫苗用Hercules毒株通过口鼻进行攻毒(n = 5);G5组的猪免疫过疫苗,用HeN1毒株通过口鼻进行攻毒(n = 5)。
分别收集所有猪3日龄(初次免疫)、6日龄、10日龄、18日龄、31日龄(强化免疫)、35日龄、38日龄和 45日龄(进行攻毒)的血液样本。在攻毒以后(45日龄),每天观察所有猪的临床体征和体温,同时每隔一天采集鼻拭子、粪便、血液样本和记录体重数据(BW),最多采集到攻毒后20天(安乐死当天),如图1。
临床体征和样本采集
每天观察三次(早上/中午/晚上)猪的临床体征。采用以下量表对每头猪的日常体征进行分级:
•直肠温度评分:(0)正常(≤39.5℃);(1)升高 (39.6 - -40.2°C);(2)发烧(40.3 - -40.9°C);(3)高烧(≥41°C),
•食欲:(0)贪吃、饥饿、食槽空槽;(1)饲喂时会采食,食槽几乎是空的,几乎没有剩料;(2)饲喂时不吃,只尝尝饲料,饲料部分被吃;(3)完全不吃,对食物不感兴趣,食槽还是满的,什么也没吃。
•活力:(0)专注(好奇,立即站起来);(1)略微减弱(犹豫地站起来,不需要人为辅助);(2)疲劳,驱赶时才站起来,再次躺下;(3)不动的,不会站起来
•步态和姿势:(0)动作协调;(1)行走犹豫或步态缓慢笨拙;(2)能够行走,但步态明显共济失调/跛行;(3)明显跛行,不能行走。
•神经症状:(0)头部和身体活动正常;(1)轻微的神经症状(如颤抖、动作不稳、协调性差);(2)更严重的神经症状(如绕圈、头压、头倾),抬起来时失去意识;(3)卧倒、失去意识、昏迷、瘫痪、划水以及抽搐/癫痫。
•其他症状:(0)无症状;(1)充血(耳、鼻、腹部和腿部),鼻炎,打喷嚏;(2)呼吸困难,消瘦;(3)死亡。
猪的每日临床评分(PDCS)为每头猪每天的体征评分之和。
在将预先称重的饲料放入喂料器之前,按照制造商的说明,使用Global Pocket Reader Plus扫描仪(美国明尼苏达州圣保罗德斯创飞灵公司)每天(早上8点)采集一次体温(调整为直肠温度)。
在样本采集当天,在临床观察和体温采集以后,对猪肌肉深层注射阿扎哌隆2-2.5 mg/kg和10-15 盐酸氯胺酮10-15 mg/kg进行镇静。动物饲养员在各组之间需要更换工作服、发网、呼吸面罩、护目镜和手套。处理顺序从对照组开始,接着是Hercules组(先是免疫组后然后是未免疫组),最后是HeN1组(先是免疫组后然后是未免疫组)。
所有抽样和测量都是在各自的负压站内进行的。从每只注射了镇静剂的猪身上,通过颈静脉穿刺采集血液,然后用预先称重的棉签采集鼻粘液和粪便。然后称每头猪的体重,计算每头猪相对于攻毒日期时的体重增加。
出现严重神经症状导致昏迷(神经评3分)或/和PDC高于10分的患病动物立即实施安乐死。这些安乐死动物的头部以及那些被发现死亡的动物的头部,被保存在- 80°C。在攻毒后20天实验结束时,所有剩余动物安乐死,并采集鼻粘膜和大脑样本,包括合并的桥脑、髓质和大脑皮层。从储存的材料中获得了类似的样品。
血清中和抗体(SN)
血清在56°C灭活30分钟,在96孔板中准备双倍稀释液检测中和(SN)抗体。稀释液与等体积的猪伪狂犬病毒(Ka毒株属于猪疱疹病毒1.2基因型)病毒液混合,其中病毒含量约有100 TCID50。37°C孵育1小时后,每个孔中加入大约25000个PK-15细胞。用Reed-Muench法计算中和抗体滴度,即5天后抑制50%细胞病变效应的最高稀释倍数的倒数。
ELISA
根据制造商的说明(爱德士),分别使用PRV/gB和PRV/gE竞争性抗体ELISA试剂盒检测血清中gE和gB抗体。
病毒定量
20% (20% w/v)悬浮液由磷酸盐缓冲盐水(PBS)中的组织制成。称量鼻拭子和粪拭子,加入1 mL PBS(在粪拭子中添加10%胎牛血清、200 IU/mL青霉素和100µg/mL链霉素),在4°C振荡60 min。
悬浮液在4°C下1000 g离心20分钟。随后,将0.1 mL上清接种于96孔板上的4孔汇合的PK-15细胞上。细胞培养5天后观察细胞病变效果。病毒定量时,将原悬液稀释十倍在细胞上滴定,终点滴度由ReedMuench法计算。
统计分析
由于所有动物都被饲养在单独的隔离器中,为了统计目的,实验单位被定义为单个猪。数据分析采用SPSS软件(25.0版本,由AUT提供)。使用G* power软件(免费版本,海因里希海涅大学),计算给定alpha(5%)、样本大小和效应大小的统计分析的实现功率,使用每个实验组的体温和体重数据作为研究的主要输出之一。对于连续定量变量(直肠温度、体重增加、鼻血滴度),除鼻排泄外,采用重复测量方差分析(ANOVA)进行组间统计比较,鼻排泄采用每天内的单因素方差分析。对于序数量表变量(即临床评分),采用非参数Kruskal-Wallis 方差分析代替。在使用Bonferroni修正法调整了出现I型错误的可能性之后,进行了事后多重比较。显著性水平为5% (P≤0.05)。
结果
临床症状
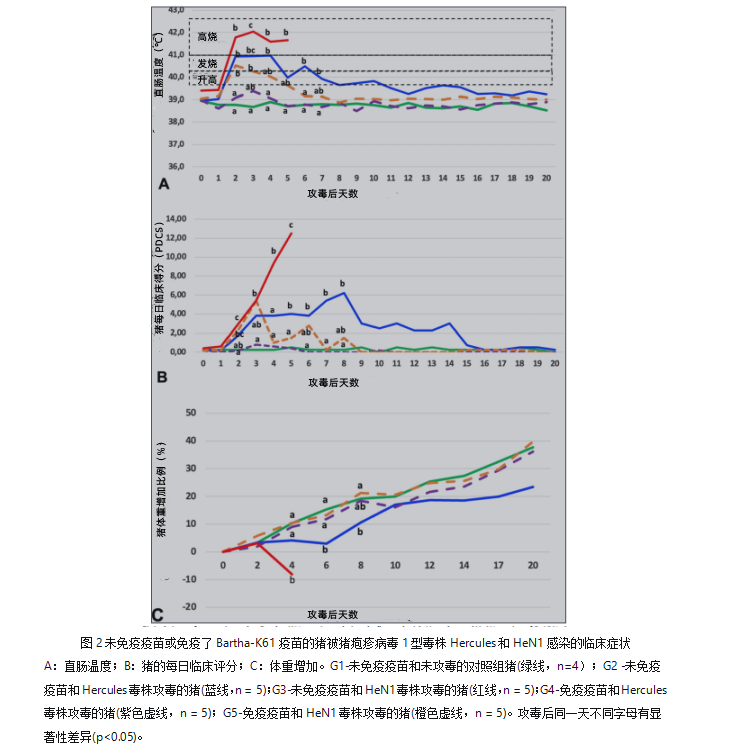
对照组(G1组)猪既无直肠温度显著升高(图2A)亦无其他临床症状(图2B)。
未免疫疫苗感染Hercules毒株的(G2组)猪中,攻毒后2-4天出现厌食症高热(平均41°C)。随后,体温略有下降,但在攻毒后第20天仍高于40°C(图2A)。其中,一头猪在攻毒后第8天出现延迟协调和头部倾斜(2级)中度神经症状,并在第二天死亡,另一头G2组猪在攻毒后第13至20天出现了头部倾斜,但没有其他临床症状。其余的G2组猪均表现出短暂的临床症状。G2组猪的每日临床评分从攻毒后第5至8天显著上升(p<0.05)(图2B)。
未免疫疫苗感染HeN1毒株的(G3组)猪中,在攻毒后第1天出现厌食高烧(平均41.6°C),随后死亡或实施安乐死。其中一头猪出现了划水的神经症状,其余G3组猪在死亡前一天仅在站立时有轻到中度的神经症状(1级或2级),例如抑郁、嗅探、咀嚼或唾液分泌过多。G3组猪在攻毒后平均第5.4天全部死亡或实施安乐死,与G2组猪相比,G3组猪神经症状出现速度更快(表1)。G3组猪的每日临床评分,从攻毒后第2天至安乐死或死亡比G1和G2组猪显著更高(p<0.05)(图2 B)。
免疫疫苗感染Hercules毒株的(G4组)猪中没有直肠温度明显升高及临床症状(图2A)(表1)。
接种疫苗感染HeN1毒株的(G5组)猪中,1头猪在攻毒后第2-3天出现高热,没有其他临床症状(图2)。4头猪出现了轻微的短暂症状(发烧,轻微抑郁),持续到攻毒后第8天(p<0.05)。每日临床评分仅在攻毒后第2,3天升高(p<0.05)(图2B)。
如图2C所示,攻毒后第4、8、20天相对体重变化:G1组猪分别增加10.3%、19.3%和37.7%;G2组猪分别增加4.1%、10.6%和23.5%;G4组猪分别增加9.0%、18.5%和36.2%;G5组猪分别为10.4%、21.2%和39.8%(图2 C)。G3组猪的相对体重在攻毒后第4天下降了约8.0%(图2 C)。与其他组相比,G2组猪在攻毒后第6和8天时的相对体重降低,G3猪在攻毒后第4天相对体重降低(p<0.05)。
抗体检测
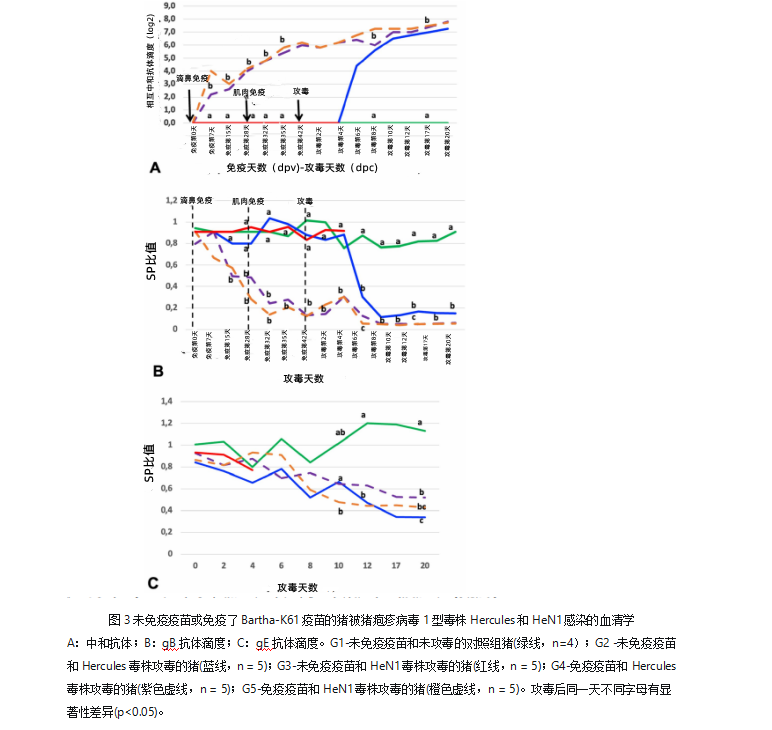
如预期的那样,G1对照组猪在任何时候未检出猪伪狂犬病毒gB和gE抗体以及血清中和抗体,G2和G3组猪在攻毒前也是如此(图3A,3B,3C)。
G2组所有猪均在攻毒后第6天检出中和抗体。到攻毒后20天这段期间内,存活猪的中和抗体滴度一直增加,从1:8增加到1:32(图3A)。在G3组猪中任何时候均未检测到抗体,直至攻毒后第4天全部死亡。G2组中所有存活的猪从攻毒后第6至20天均检出猪伪狂犬病毒gB抗体,期间在攻毒后第8天达到平台期直到结束(图3B)。G2组猪伪狂犬病毒gE抗体的变化与gB抗体大致相同(图3C)。
在免疫组(G4组和G5组)中,在10日龄即第一次滴鼻免疫后第七天,所有的猪均检测到中和抗体,抗体滴度从1:4到1:32不等。在31日龄即加强免疫疫苗(肌注)当天,所有猪中和抗体滴度均为1/16(图3A)。在45日龄即攻毒当天,除一头猪外,所有猪的中和抗体滴度均为1/64或更多,且逐渐增加至攻毒后第20天。
在免疫组(G4组和G5组)中,仅1头猪在首次免疫1周后(10日龄)检测到猪伪狂犬病毒gB抗体,60%的猪在18日龄时检测到猪伪狂犬病毒gB抗体。在31日龄时,即加强免疫疫苗(肌注)当天,几乎所有猪均检测到猪伪狂犬病毒gB抗体且一直到攻毒后第20天。首次滴鼻免疫后一周,抗体滴度开始增加直至第二次肌肉疫苗免疫,并在加强免疫以后抗体滴度轻微增加达到平台期直至实验结束(图3B)。
在免疫组(G4组和G5组)中,少量猪在首次攻毒后第2和6天时检测到猪伪狂犬病毒gE抗体。60%的猪在攻毒后第8天gE抗体变阳性。随着时间的推移,可观察到轻微的增加达到平台期直至实验结束(图3C)。
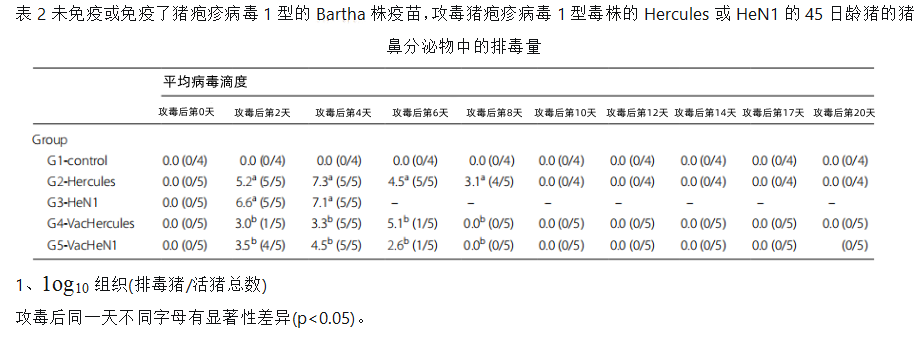
病毒排毒
从G1对照组的鼻拭子在任何一天都未分离到病毒(表2)。G2组和G3组所有猪在攻毒后第2天排毒,其排毒量超过5.2 log10 TCID50/g直至攻毒后第8天,或者直到安乐死或死亡(如果更早的话)。攻毒8天后,未接种疫苗的猪鼻分泌物中未检测到病毒(表2)。
在免疫疫苗感染Hercules毒株的(G4组)猪中,病毒排毒主要在攻毒后第4天(表2),而在免疫疫苗感染HeN1毒株的(G5组)猪中病毒排毒主要在攻毒后第2和4天(表2)。攻毒6天后,接种疫苗的猪鼻分泌物中未检测到病毒(表2)。
任何时候未在粪便中检测到这两种毒株的排毒。
病毒在组织中的复制
任何时候未在G1对照组猪组织中检测到传染性病毒。
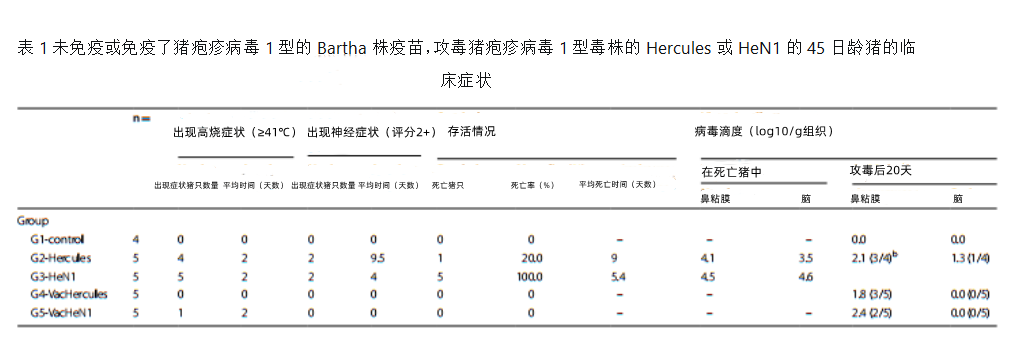
在未免疫疫苗攻毒组(G2组和G3组)被安乐死或死亡猪中,从鼻粘膜和大脑中分离到中等滴度病毒。在未免疫疫苗感染Hercules毒株的(G2组)存活到攻毒后20天的4头猪中,从3头猪的鼻粘膜以及1头猪的大脑处分离到低水平病毒(表1)。
所有免疫疫苗的猪均存活,只有G4组中的3头猪和G5组中的2头猪猪从鼻粘膜处分离到低水平病毒,大脑均未分离到病毒。
统计效力分析
功效分析使用攻毒后第4天体重和体温度数据,例如,所有活猪显示体重效果大小为0.8897409,效力为0.8432532,体温效应大小1.7227199,效力为0.9999979。
讨论
在本研究中,我们比较了最近从田间分离的两种毒株(一种来自欧洲,另一种来自中国)对血清抗体阴性猪和免疫了Bartha-K61疫苗的猪的致病性。
与猪场田间研究相比,我们的封闭试验体系提供了定量评估攻毒的临床效果或/和疫苗保护效果的机会,在试验期间没有其他可能影响结果的主要或次要因素存在。事实上,尽管此前有若干研究人员的田间观察,导致人们对Bartha-K61疫苗保护猪免受猪伪狂犬病毒田间变异毒株的效果产生了怀疑,但也不能完全排除可能的混合感染或与其他猪场病原体(如蓝耳、猪瘟、圆环、细小、猪支原体等)的持续感染的影响,也不能完全排除使用质量低劣的疫苗或储存以及不适当的免疫方案或/和糟糕的生物安全措施。只有在实验室封闭条件下,可以有效地控制或排除所有混杂参数,因此在实验室封闭条件下的实验研究才能确定疫苗交叉保护有效性的确切结论。
与使用圈栏作为实验单元的研究相比,我们在这项研究中使用了单独饲养的动物。于是,按照3Rs原则(替换、减少、细化),实验动物的数量最小化,同时增加了试验结果的统计效力。事实上,结果表明,在所有情况下,检测到疫苗效果的统计能力都高于平均值比较统计检验的可接受能力,即80%。
使用负压高效空气过滤房,防止病毒逃逸到环境中,确保了动物之间没有交叉污染,在整个试验过程中对照动物均为阴性证明了这一点。在同一组中,没有交叉感染可能是有益的,因为受影响较小的动物的健康不会因受影响较大的动物而恶化,从而影响各自的参数。
当比较两种毒株在抗体阴性猪体内的临床效果时,它们的毒力明显不同。与Hercules毒株相比,HeN1毒株的毒力更大,死亡率更高,离安乐死或死亡的时间更短,临床评分更高(p<0.05)。值得注意的是,大多数感染HeN1毒株的猪在死之前一天不总是表现出严重的神经症状。在先前使用欧洲基因型毒株的研究中已经证实了毒株的毒力增强,在最近使用中国基因型毒株的研究中也证实了这一点。在我们的研究中,从G3组抗体阴性的所有死亡猪中均分离出HeN1毒株,每克组织的病毒滴度为103.1至105.6 TCID50。然而,我们目前还没有找到大脑或其他器官受到影响的确切位置,这可能为疾病的进展和快速进程提供进一步的信息。
基于Bartha-K61毒株的多个疫苗对中国新出现的伪狂犬变异毒株的保护性已有一些研究报道,涵盖了不同的免疫方案、免疫剂量、不同的动物模型,免疫年龄、攻毒途径和剂量,在另外一些研究中,这些变异毒株的致病性用非猪物种(绵羊、小鼠)作为替代动物进行了评估。然而,众所周知猪伪狂犬病毒的神经症状的致病机制在非自然宿主的动物中可能是不同的,这种从非猪宿主到猪宿主的推断可能是误导性的。此外,一些研究人员对这些研究中使用的疫苗剂量、免疫途径或/和方案的合理性表示了怀疑。在我们的研究中,我们按照《世界动物卫生组织陆生动物手册2018年版》的指导,通过自然感染途径对敏感年龄的宿主动物(猪)进行非常高的剂量的攻毒。该模型比大多数其他攻毒研究中的攻毒剂量要高得多,在类似或更大年龄的猪身上接种的病毒至少是前者的10或100倍。为了在如此高剂量攻毒方案下提供保护,我们选择了一种既能诱导局部免疫力(粘膜免疫力,译者注)又能诱导体系统免疫力的疫苗接种方案。从我们的结果可以清楚地看出,接种Bartha-K61疫苗几乎可以同样地保护猪免受两种毒株的感染,因为我们发现两组免疫猪只攻毒后都显著降低了发病率和死亡率,排毒减少和短暂排毒,发热很少或没有。同样有趣的是,在我们的研究中,所有免疫疫苗的猪的大脑中没有分离出病毒,而在1只未免疫疫苗但用Hercules攻毒后存活20天的猪只大脑中分离到病毒(表1),这意味潜伏感染的发生是可能的,而免疫疫苗能有效减少潜伏感染的发生。
评估疫苗功效的另一个关键参数是体重减轻,这对健康和经济性都很重要。在我们的实验中,Hercules和HeN1毒株攻毒的免疫猪只的增重(G4组和G5组)都没有受到影响,并遵循与未感染的对照猪完全相同的生长曲线(图2C),这是证明所测试的疫苗对两种毒株都有效的又一个证据。
两种毒株攻毒抗体阴性猪后,在攻毒后第6天检测到中和抗体,同时用ELISA 检测到相关抗体(gB抗体为攻毒后第4天, gE抗体为攻毒后第6 天),发病猪中和抗体的平均滴度为1:32。滴鼻免疫也可快速诱导系统免疫力,并随着时间逐步增加,然后通过肌肉免疫进一步增强。在攻毒时,免疫疫苗的猪的平均中和抗体滴度为1:64。但值得注意的是,保护力或排毒与中和抗体的水平不相关,而与细胞免疫有关。滴鼻免疫疫苗使病毒在鼻腔复制的减少(例如排毒猪的数量减少,两种毒株排毒的时间和排毒量的也都减少了),证明了额外的滴鼻免疫能够在鼻粘膜建立了重要的局部免疫力。与肌肉免疫相比,滴鼻免疫Bartha-K61毒株在攻毒的条件下证明可以诱导更好的免疫力(例如临床症状的减轻)。因此,按照使用说明推荐,目前使用的疫苗免疫方案(滴鼻+肌注,同时诱导局部和全身免疫),显然比大多数评估Bartha-K61毒株对中国变异毒株的有效性的研究中采用的单次或两次肌注免疫更有效。特别是在使用大剂量攻毒模型来评估对不同毒株的交叉保护时(如本文所使用的),这可能是一个更好的免疫方案。
猪伪狂犬病毒的田间分离株,即使同样是欧洲基因型,其毒力也可能不同。在北爱尔兰的一次疫情中,NIA3毒株导致14周龄至20周龄的猪的死亡率高达13%,而其他毒株如NIA1和NIA2对这个年龄段的猪没有表现出高毒力。在实验条件下,NIA3毒株还能引起15周龄猪严重的神经症状。然而,当基于gE基因缺失疫苗(例如Bartha-K61株)的强制免疫净化方案得到系统实施时,受影响地区的这些野毒株能够被净化。相反,如果伪狂犬净化计划没有得到强制和正取的执行,正如希腊免疫疫苗的情形,疫苗免疫只会减轻猪伪狂犬病毒的临床症状,而不会净化病毒。这就是为什么近30%的希腊猪场gE抗体是阳性的。类似的情况也可能发生在中国,例如在上海地区,据报道67.8%的养猪场gE抗体呈阳性。
到目前为止,中国研究中提及的新一代候选疫苗大多数是各自攻毒毒株的致弱版本。尽管人们相信,疫苗与一个地区流行的野毒株的基因同源性越高,其免疫原性和保护性可能就越好,但为了确保疫苗的成功,必须长期测试某些特性,例如,必须广泛研究疫苗的安全性和有效性、基因稳定性、对不同的田间毒株的交叉保护(而目前田间感染的伪狂犬野毒毒株大多是未详尽研究的)。
总之,本研究表明,Bartha-K61疫苗株是一种经过长期应用和试验的通用疫苗,如果使用得当,对新出现的猪伪狂犬病毒毒株具有有效的保护作用。

徐晓杰
天康制药技术服务经理
南京农业大学预防兽医学硕士,执业兽医师。先后在江苏温氏、江苏华丽等公司从事猪群健康管理、疾病防控以及猪场规划。
最新发布